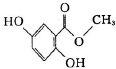
题目内容
20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0mol?L-1,则下列说法中不正确的是( )
| A、20℃时,饱和KCl溶液与等质量的水混合后物质的量浓度大于2.0mol?L-1 |
| B、20℃时,将29.8 gKCl溶于87.6g水中可得饱和溶液 |
| C、20℃时,密度小于1.174g?cm-3的KCl溶液是不饱和溶液 |
| D、将此溶液蒸发部分水,再恢复到20℃时,溶液中各离子的浓度不变 |
考点:物质的量浓度,溶解度、饱和溶液的概念
专题:物质的量浓度和溶解度专题
分析:A、温度越高KCl的溶解度越高,浓度越大;
B、设饱和溶液的体积为1L,计算溶液的质量和溶质的质量,进而计算溶质的质量分数,然后根据计算出29.8 gKCl溶于87.6g水中溶质的质量百分数,最后根比较溶质的质量百分数与饱和溶液中溶质的质量分数可知;
C、KCl溶液的浓度越大密度越大;
D、将此溶液蒸发部分水,再恢复到20℃时,KCl溶解度不变,剩余溶液是饱和溶液.
B、设饱和溶液的体积为1L,计算溶液的质量和溶质的质量,进而计算溶质的质量分数,然后根据计算出29.8 gKCl溶于87.6g水中溶质的质量百分数,最后根比较溶质的质量百分数与饱和溶液中溶质的质量分数可知;
C、KCl溶液的浓度越大密度越大;
D、将此溶液蒸发部分水,再恢复到20℃时,KCl溶解度不变,剩余溶液是饱和溶液.
解答:
解:A、KCl的溶解度随温度升高而增大,所以饱和溶液浓度会增大,20℃时是4mol/L,则25℃时大于4mol/L,故A错误;
B、设饱和溶液的体积为1L,溶液的质量为1.174g/ml×1000ml=1174g,溶质的物质的量为1L×4.0mol/L=4mol,质量为4mol×74.5g/mol=298g,所以溶液的质量分数为
×100%=25.38%,将29.8gKCl溶于
×100%=25.38%,两者相当,所以所得溶液为饱和溶液,故B正确;
C、KCl溶液的浓度越大密度越大,故20℃时,密度小于1.174 g?cm-3的KCl溶液是不饱和溶,故C正确;
D、若将饱和溶液蒸发,则有KCl晶体析出.再恢复到20℃时,其溶解度不变,溶液仍为饱和溶液,溶液中各离子的浓度不变,故D正确;
故选A.
B、设饱和溶液的体积为1L,溶液的质量为1.174g/ml×1000ml=1174g,溶质的物质的量为1L×4.0mol/L=4mol,质量为4mol×74.5g/mol=298g,所以溶液的质量分数为
| 298 |
| 1174 |
| 29.8g |
| 29.8g+87.6g |
C、KCl溶液的浓度越大密度越大,故20℃时,密度小于1.174 g?cm-3的KCl溶液是不饱和溶,故C正确;
D、若将饱和溶液蒸发,则有KCl晶体析出.再恢复到20℃时,其溶解度不变,溶液仍为饱和溶液,溶液中各离子的浓度不变,故D正确;
故选A.
点评:本题考查物质的量浓度、溶解度、溶液的性质等,难度不大,注意掌握温度与溶解度的关系.

练习册系列答案
相关题目
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示.下列判断中,正确的是( )
| 密闭容器体积/L | 甲 | 乙 | 丙 | 丁 | |
| 2 | 2 | 2 | 1 | ||
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A、甲中反应的平衡常数小于乙 |
| B、该温度下,甲和乙中反应的平衡常数K均为400 |
| C、SO2的平衡转化率:α1>α2=α3 |
| D、容器中SO3的物质的量浓度:丙>甲=丁 |
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子.下列关于天然气水合物中两种分子极性的描述正确的是( )
| A、两种都是极性分子 |
| B、两种都是非极性分子 |
| C、CH4是极性分子,H2O是非极性分子 |
| D、H2O是极性分子,CH4是非极性分子 |
下列关于CO和N2的判断错误的是( )
| A、体积相等时质量一定相等 |
| B、电子数相等时具有相等的原子数 |
| C、同温同压下质子数相等则体积相等 |
| D、质量相等时具有相等的分子数 |
某温度下在密闭容器中发生如下反应:2SO2+O2?2SO3(g),若开始时只充入2mol SO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2mol SO2和1mol O2的混合气体,达到平衡时SO2的转化率为( )
| A、20% | B、40% |
| C、50% | D、60% |
用Cl2消毒的自来水养金鱼之前,需要把水放在阳光下曝晒一段时间的主要目的是( )
| A、增加水中氧气的含量 |
| B、提高水温 |
| C、除去次氯酸 |
| D、利用紫外线杀菌 |
| E、利用紫外线杀菌 |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,11.2L氮气所含的原子数目为NA |
| B、NA个甲烷分子和1mol甲烷的质量相等 |
| C、2L 1mol?L-1的盐酸中所含氯化氢分子数约为2NA |
| D、常温下,0.05mol CO和SO2混合气体中所含氧原子数为0.1NA |