题目内容
12.某工业废水中可能含有Fe2+、Cu2+、Fe3+、NO3-、Cl-中的两种或多种.下列结论正确的是( )| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 经测定一定量的废水中n(Cu2+)=0.02 mol,n(Fe2+)+n(Fe3+)=0.02 mol,则该一定量的废水中0 mol≤n(Cl-)≤0.1 mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4 mL恰好完全反应.然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.32 g,则废水中c(Fe3+)=0.02 mol•L-1 |
分析 A.若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],NO3-浓度较大时,阴离子电荷总数多;
B.加适量盐酸,滴加KSCN溶液,溶液变红,可能亚铁离子被NO3-氧化;
C.由电荷守恒可知,若只有铁离子、铜离子、氯离子,则n(Cl-)=0.02×2+0.02×3=0.1mol;
D.0.32g为氧化铁,n(Fe)=$\frac{0.32g}{160g/mol}$×2=0.04mol,由电子守恒可计算亚铁离子的物质的量,结合c=$\frac{n}{V}$计算.
解答 解:A.若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],NO3-浓度较大时,阴离子电荷总数多,则由电荷守恒可知,溶液中可能存在Fe3+,故A错误;
B.加适量盐酸,滴加KSCN溶液,溶液变红,可能亚铁离子被NO3-氧化,不能确定是否含Fe3+,故B错误;
C.由电荷守恒可知,若只有铁离子、铜离子、氯离子,则n(Cl-)=0.02×2+0.02×3=0.1mol,溶液中可能不含氯离子,则该一定量的废水中0 mol≤n(Cl-)≤0.1 mol,故C正确;
D.0.32g为氧化铁,n(Fe)=$\frac{0.32g}{160g/mol}$×2=0.04mol,由电子守恒可知,n(Fe2+)=$\frac{0.0224L}{22.4L/mol}$×2×(1-0)=0.002mol,c(Fe3+)=$\frac{n}{V}$=$\frac{0.038mol}{0.01L}$=3.8mol/L,故D错误;
故选C.
点评 本题考查氧化还原反应计算及离子推断,为高考常见题型和高频考点,侧重于学生的分析能力和应用能力的考查,注意把握电子、电荷守恒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.温度为T1(T1=25℃)和T2时,水溶液中水的离子积曲线如图所示:下列判断错误的是( )
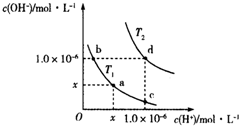

| A. | T2>25℃ | B. | x=1.0×10-7 | ||
| C. | KW(a)=KW(d) | D. | b点溶液呈碱性,c点溶液呈酸性 |
3.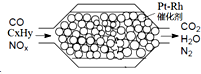 汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”.因此,不少汽车都安装尾气净化装置(净化处理过程如图).下列有关叙述,错误的是( )
汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”.因此,不少汽车都安装尾气净化装置(净化处理过程如图).下列有关叙述,错误的是( )
 汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”.因此,不少汽车都安装尾气净化装置(净化处理过程如图).下列有关叙述,错误的是( )
汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”.因此,不少汽车都安装尾气净化装置(净化处理过程如图).下列有关叙述,错误的是( )| A. | 尾气造成“雾霾”与汽油未充分燃烧有关 | |
| B. | 尾气处理过程,氮氧化物(NOX)被还原 | |
| C. | Pt-Rh催化剂可提高尾气净化反应的平衡转化率 | |
| D. | 使用氢氧燃料电池作汽车动力能有效控制雾霾 |
20.下列化学用语表示正确的是( )
| A. | 乙醇的结构简式:C2H6O | |
| B. | Al3+的结构示意图: | |
| C. | CO2的电子式: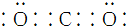 | |
| D. | NaHCO3的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
7.下列关于苯的说法正确的是( )
| A. | 密度比水大 | B. | 能发生取代反应 | ||
| C. | 不能发生燃烧反应 | D. | 不能发生加成反应 |
17. 金属有机骨架材料(MOFs)为继碳纳米管后的又一种新型多孔材料.如图所示有机物可用于合成该材料,下列有关该有机物的说法不正确的是( )
金属有机骨架材料(MOFs)为继碳纳米管后的又一种新型多孔材料.如图所示有机物可用于合成该材料,下列有关该有机物的说法不正确的是( )
 金属有机骨架材料(MOFs)为继碳纳米管后的又一种新型多孔材料.如图所示有机物可用于合成该材料,下列有关该有机物的说法不正确的是( )
金属有机骨架材料(MOFs)为继碳纳米管后的又一种新型多孔材料.如图所示有机物可用于合成该材料,下列有关该有机物的说法不正确的是( )| A. | 6.8g该有机物含0.2 molN | |
| B. | 该有机物能发生加成反应 | |
| C. | 该有机物的一氯代物只有2种 | |
| D. | 分子中的所有原子可能处于同一平面 |
4.如图是一种微生物燃料电池的原理示意图.下列有关该微生物燃料电池的说法正确的是( ) 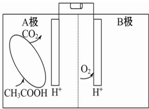

| A. | A极为正极,B极为负极 | |
| B. | 电池内电解质溶液中所含的H+由B极移向A极 | |
| C. | A极的电极反应为:CH3COOH-8e-+2H2O═2CO2↑+8H+ | |
| D. | 电池工作过程中,电解质溶液的pH会明显下降 |
1.下列实验操作正确的是( )


| A. | 用图1示装置制备Cl2 | |
| B. | 将混合气体通过装有NaOH溶液的洗气瓶除去Cl2中混有的HCl | |
| C. | 用图2示装置分离CH3COOC2H5与饱和Na2CO3溶液 | |
| D. | 称取1.06 g Na2CO3固体,置于100 mL容量瓶中,加水稀释,配制0.10 mol•L-1的Na2CO3溶液 |
2.下列除去杂质的方法正确的是(括号内的是杂质)( )
| A. | N2(CO):通过灼热的CuO粉末 | B. | Na2SO4溶液(Na2CO3):加盐酸 | ||
| C. | NaCl(NH4Cl):加热 | D. | NO2(NO):通入水中 |