题目内容
3.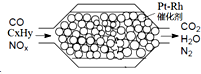 汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”.因此,不少汽车都安装尾气净化装置(净化处理过程如图).下列有关叙述,错误的是( )
汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”.因此,不少汽车都安装尾气净化装置(净化处理过程如图).下列有关叙述,错误的是( )| A. | 尾气造成“雾霾”与汽油未充分燃烧有关 | |
| B. | 尾气处理过程,氮氧化物(NOX)被还原 | |
| C. | Pt-Rh催化剂可提高尾气净化反应的平衡转化率 | |
| D. | 使用氢氧燃料电池作汽车动力能有效控制雾霾 |
分析 A.汽油未充分燃烧,空气中含有可吸入颗粒物;
B.NOX被还原生成氮气;
C.催化剂只能改变反应速率,不能改变平衡移动;
D.氢氧燃料电池产物为水,不污染环境.
解答 解:A.汽油未充分燃烧,空气中含有可吸入颗粒物,可造成“雾霾”,故A正确;
B.NOX生成氮气,N元素化合价降低,被还原,故B正确;
C.催化剂只能改变反应速率,不能改变平衡移动,所以不能提高尾气平衡转化率,故C错误;
D.氢氧燃料电池产物为水,不污染环境,故D正确.
故选C.
点评 本题考查较为综合,涉及氧化还原反应、外界条件对速率和平衡的影响等知识,侧重于化学与环境保护、生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
1.下列反应中不属于加成反应的是( )
| A. |  | |
| B. | CH2═CH-CH═CH2+2H2$→_{△}^{催化剂}$CH3-CH2-CH2-CH3 | |
| C. |  | |
| D. | CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr |
2.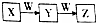 X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )
X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )
 X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )
X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )| A. | Al | B. | Si | C. | O2 | D. | Fe |
11.向某无色溶液中加入氢氧化铝,氢氧化铝迅速溶解,则该溶液中一定能够大量共存的离子组是( )
| A. | K+、Ba2+、N${O}_{3}^{-}$、Cl- | B. | Na+、N${H}_{4}^{+}$、S${O}_{4}^{2-}$、Cl- | ||
| C. | Na+、H+、C${O}_{3}^{2-}$、N${O}_{3}^{-}$ | D. | Na+、K+、Mn${O}_{4}^{-}$、Br- |
15.下列物质溶于水所得溶液呈酸性的是( )
| A. | NH3 | B. | NaCl | C. | NaHCO3 | D. | SO2 |
12.某工业废水中可能含有Fe2+、Cu2+、Fe3+、NO3-、Cl-中的两种或多种.下列结论正确的是( )
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 经测定一定量的废水中n(Cu2+)=0.02 mol,n(Fe2+)+n(Fe3+)=0.02 mol,则该一定量的废水中0 mol≤n(Cl-)≤0.1 mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4 mL恰好完全反应.然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.32 g,则废水中c(Fe3+)=0.02 mol•L-1 |
13.以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
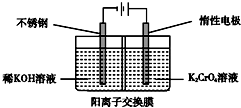
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 在阴极室,发生的电极反应为2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程中总反应的化学方程式为4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1 |