题目内容
2.下列除去杂质的方法正确的是(括号内的是杂质)( )| A. | N2(CO):通过灼热的CuO粉末 | B. | Na2SO4溶液(Na2CO3):加盐酸 | ||
| C. | NaCl(NH4Cl):加热 | D. | NO2(NO):通入水中 |
分析 A.CO还原CuO生成二氧化碳;
B.碳酸钠与盐酸反应生成氯化钠;
C.加热氯化铵分解,而NaCl不能;
D.二氧化氮与水反应.
解答 解:A.CO还原CuO生成二氧化碳,引入新杂质,故A错误;
B.碳酸钠与盐酸反应生成氯化钠,引入新杂质NaCl,应利用硫酸除杂,故B错误;
C.加热氯化铵分解,而NaCl不能,则加热可除杂,故C正确;
D.二氧化氮与水反应,将原物质除去,不能除杂,故D错误;
故选C.
点评 本题考查物质的分离提纯,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,除杂时不能引入新杂质,更不能影响被提纯物质的性质,难度不大.

练习册系列答案
相关题目
12.某工业废水中可能含有Fe2+、Cu2+、Fe3+、NO3-、Cl-中的两种或多种.下列结论正确的是( )
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 经测定一定量的废水中n(Cu2+)=0.02 mol,n(Fe2+)+n(Fe3+)=0.02 mol,则该一定量的废水中0 mol≤n(Cl-)≤0.1 mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4 mL恰好完全反应.然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.32 g,则废水中c(Fe3+)=0.02 mol•L-1 |
13.以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
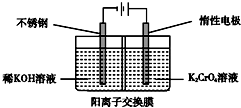
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 在阴极室,发生的电极反应为2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程中总反应的化学方程式为4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1 |
17.如图所示,室温时甲、乙两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下止水夹K,使两烧瓶内气体充分接触后,容器内压强最大的是( )
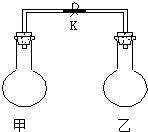
| 编号 | A | B | C | D |
| 甲中气体 | H2S | H2 | NH3 | NO |
| 乙中气体 | SO2 | Cl2 | HCl | O2 |

| A. | A | B. | B | C. | C | D. | D |
14.我国科学家成功地研制出一种长期依赖进口、价格昂贵的物质18O2.下列说法正确的是( )
| A. | 它是O3的一种同素异形体 | B. | 它是16O2的同分异构体 | ||
| C. | 18O2与16O2互为同位素 | D. | 1mol18O2分子中含有20mol电子 |
11.通常用于金属制品表面防腐的“银粉”,实际上是下列哪种金属粉末( )
| A. | Al | B. | Mg | C. | Cu | D. | Au |
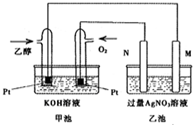 在298K时,1mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8kJ.
在298K时,1mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8kJ.