题目内容
20.下列化学用语表示正确的是( )| A. | 乙醇的结构简式:C2H6O | |
| B. | Al3+的结构示意图: | |
| C. | CO2的电子式: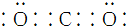 | |
| D. | NaHCO3的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
分析 A.C2H6O是乙醇的分子式,结构简式应体现官能团是羟基;
B.铝是13号元素,最外层有3个电子,Al3是将原子的外层电子失去,次外层做最外层;
C.CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对;
D.碳酸氢钠为强电解质,完全电离,注意碳酸氢根离子为弱酸的酸式根离子不能拆.
解答 解:A.乙醇的官能团是羟基,乙醇的结构简式为:CH3CH2OH,故A错误;
B.铝是13号元素,最外层有3个电子,Al3+是将原子的外层电子失去,次外层做最外层,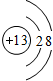 ,故B错误;
,故B错误;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故C正确;
,故C正确;
D.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故D错误;
故选C.
点评 本题考查化学用语的书写规范性,注意掌握常见物质的电子式、微粒的核外电子排布、酸式盐的电离方程式,题目难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
11.向某无色溶液中加入氢氧化铝,氢氧化铝迅速溶解,则该溶液中一定能够大量共存的离子组是( )
| A. | K+、Ba2+、N${O}_{3}^{-}$、Cl- | B. | Na+、N${H}_{4}^{+}$、S${O}_{4}^{2-}$、Cl- | ||
| C. | Na+、H+、C${O}_{3}^{2-}$、N${O}_{3}^{-}$ | D. | Na+、K+、Mn${O}_{4}^{-}$、Br- |
15.下列物质溶于水所得溶液呈酸性的是( )
| A. | NH3 | B. | NaCl | C. | NaHCO3 | D. | SO2 |
5.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 1 mol Mg转变为Mg2+失去的电子数目为NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 标准状况下,22.4 L CO2、CO的混合气中含有的碳原子数目为NA |
12.某工业废水中可能含有Fe2+、Cu2+、Fe3+、NO3-、Cl-中的两种或多种.下列结论正确的是( )
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 经测定一定量的废水中n(Cu2+)=0.02 mol,n(Fe2+)+n(Fe3+)=0.02 mol,则该一定量的废水中0 mol≤n(Cl-)≤0.1 mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4 mL恰好完全反应.然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.32 g,则废水中c(Fe3+)=0.02 mol•L-1 |
9.如图是298K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
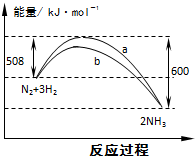

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1molN2和3molH2充分反应后,放出92kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 加入正催化剂可增大正反应速率,降低逆反应速率 |