题目内容
16.关于可逆反应X2(g)+3Y2(g)?2XY3(g)+Q(Q>0),下列叙述正确的是( )| A. | 恒温恒压下,若混合气体密度不变,说明反应已达平衡 | |
| B. | 恒容时通入氩气,压强不变,正逆反应速率也不变 | |
| C. | 降低温度可以缩短反应达到平衡的时间 | |
| D. | 恒容时通入X2,平衡向正反应方向移动,平衡常数不变 |
分析 A.恒温恒压条件下气体质量不变,体积不变密度不变,说明物质浓度不变,反应达到平衡状态;
B.恒容时通入氩气,总压增大,气体分压不变,正逆反应速率不变;
C.降低温度反应速率减小;
D.恒容时通入X2,平衡正向进行,温度不变平衡常数不变;
解答 解:A.恒温恒压条件下气体质量不变,体积不变,才能使气体密度不变,当密度不变物质浓度不变,反应达到平衡状态,故A正确;
B.恒容时通入氩气,总压增大,气体分压不变,正逆反应速率不变,故B错误;
C.降低温度反应速率减小,反应达到平衡的时间增长,故C错误;
D.恒容时通入X2,平衡正向进行,温度不变平衡常数不变,故D正确;
故选AD.
点评 本题考查了化学平衡、化学反应速率影响因素分析判断,注意容器的特征分析,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18. 伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )
伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )
 伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )
伏打电堆(Voltaic pile)的照片和结构如图.它用圆形的锌板、铜板间隔堆积而成.所有的圆板之间夹放几层盐水泡过的布.下列说法正确的是( )| A. | 伏打电堆能将电能转化成化学能 | B. | 锌是正极 | ||
| C. | 盐水是电解质溶液 | D. | 伏打电堆工作时铜被还原 |
7.下列有关平衡常数的说法正确的是( )
| A. | 已知K=$\frac{{c}^{2}C{O}_{2}•{c}^{6}•{H}_{2}}{{c}^{3}{H}_{2}O•cC{H}_{3}C{H}_{2}OH}$,则对应的化学反应可以表示为2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g) | |
| B. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离度(α)和电离平衡常数Ka都变大 | |
| C. | 常温下,向纯水中加入碳酸钠,水的电离程度变大,KW变大 | |
| D. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 |
11. 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
(1)反应的平衡常数表达式为=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$
(2)下列描述中能说明上述反应已达到平衡的是bd(填序号)
a.v(O2)正=2v(SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)在上述平衡体系中加入18O2,当平衡发生移动后,SO2中18O的百分含量增加(填增加、减少、不变)其原因是该反应是可逆反应,在SO2和18O2反应生成S18O3的同时,S18O3又分解生成S18O2.
(4)一定温度下,把2molSO2和1molO2通入一恒容密闭容器中,平衡时SO3的体积分数为x.保持温度不变,若初始加入的SO2、O2和SO3的物质的量分别为a、b、c,当a、b、c的取值满足下列关系时才能保证达到平衡时SO3的体积分数仍为x.
①a+c=2(填a与c的关系)、②2b+c=2(填b、c的关系).
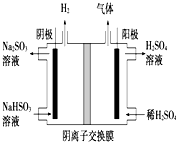
(5)工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式4OH--4e-=2H2O+O2,阳极区逸出气体的成分为O2、SO2(填化学式).
 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:| 温 度 | 200℃300℃400℃ |
| 平衡常数 | K1 K2 K3 |
(2)下列描述中能说明上述反应已达到平衡的是bd(填序号)
a.v(O2)正=2v(SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)在上述平衡体系中加入18O2,当平衡发生移动后,SO2中18O的百分含量增加(填增加、减少、不变)其原因是该反应是可逆反应,在SO2和18O2反应生成S18O3的同时,S18O3又分解生成S18O2.
(4)一定温度下,把2molSO2和1molO2通入一恒容密闭容器中,平衡时SO3的体积分数为x.保持温度不变,若初始加入的SO2、O2和SO3的物质的量分别为a、b、c,当a、b、c的取值满足下列关系时才能保证达到平衡时SO3的体积分数仍为x.
①a+c=2(填a与c的关系)、②2b+c=2(填b、c的关系).
(5)工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式4OH--4e-=2H2O+O2,阳极区逸出气体的成分为O2、SO2(填化学式).
1.下列关于物质或离子检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 在溶液中加稀盐酸,无现象,继续加入BaCl2溶液产生白色沉淀,证明原溶液有SO42- |
6.下列物质均能使某些有色物质褪色,但褪色原理不同于其它3个的是( )
| A. | H2O2 | B. | HClO | C. | Cl2 | D. | SO2 |
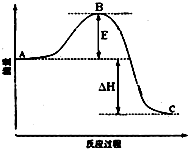 安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.
安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.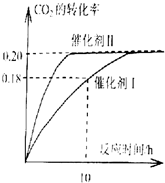 已知CO2可以生产绿色燃料甲醇,反应如下:
已知CO2可以生产绿色燃料甲醇,反应如下: