题目内容
3.下列叙述正确的是( )| A. | 合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 酸碱中和滴定时,锥形瓶需用待测液润洗2~3次,再加入待测液 | |
| C. | 将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 | |
| D. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
分析 A、移走NH3,正逆反应速率速率都减小,平衡正向移动;
B、酸碱中和滴定时,锥形瓶不需用待测液润洗;
C、增大压强,平衡虽向四氧化二氮方向移动,但体积缩小二氧化氮的浓度变大;
D、电解过程中,阳极上不仅有铜还有其它金属失电子.
解答 解:A、移走NH3,正逆反应速率速率都减小,平衡正向移动,所以提高原料转化率,故A错误;
B、酸碱中和滴定时,锥形瓶不需用待测液润洗,否则会导致消耗标准液体积变大,故B错误;
C、增大压强,平衡虽向四氧化二氮方向移动,但体积缩小二氧化氮的浓度变大,所以气体颜色加深,故C正确;
D、电解过程中,阳极上不仅有铜还有其它金属失电子,阴极上只有铜离子得电子,所以阳极减少的质量不等于阴极增加的质量,故D错误;
故选C.
点评 本题考查电解原理和电解池原理的应用、中和滴定、压强对反应的影响,为高频考点,明确电解精炼铜过程中阳极上不仅有铜还有其它金属失电子是解本题关键,题目难度不大.

练习册系列答案
相关题目
13.下面关于多电子原子核外电子的运动规律的叙述正确的是( )
| A. | 核外电子是分层运动的 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 不同能量的电子在核外运动占有的区域形状可能不同 |
14.下列有关仪器的使用方法或实验操作正确的是( )
| A. | 实验室配制一定物质的量浓度NaCl溶液,用托盘天平秤取5.85gNaCl | |
| B. | 用容量瓶配制溶液时先将容量瓶洗涤并烘干 | |
| C. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| D. | 酸碱滴定时当指示剂变色后保持半分钟内不变色即达滴定终点 |
11.下列说法正确的是( )
| A. | 2 mol•L-1 KCl溶液与1 mol•L-1 K2SO4溶液等体积混合后,c(K+)为2 mol•L-1 | |
| B. | 120 g NaCl溶液中溶有20 g NaCl,该温度下NaCl的溶解度为20 g | |
| C. | 22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mol•L-1 | |
| D. | 把5 g胆矾溶于45 g水中,所得溶液溶质的质量分数为10% |
15.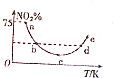 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )| A. | 10s内,图中a点对应的N2O4反应速率为0.01mol•L-1•s-1 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | c点前后平衡移动的方向相反 | |
| D. | e点对应的容器中气体颜色最深 |
12.在一定温度下反应:2NO2(g)═N2O4(g)△H<0,其化学平衡常数为K,则下列说法正确的是( )
| A. | 相同温度,2N2O4(g)═4NO2(g)的反应热和化学平衡常数分别为-2△H和K2 | |
| B. | 该反应达到平衡后,缩小容器的容积,平衡右移,混合气体颜色变浅 | |
| C. | 若投入2mol NO2,通过控制外界条件,必能生成1mol N2O4 | |
| D. | 平衡时一定有v正(NO2)=2v逆(N2O4) |
13.甲烷分子中的4个氢原子都可以被取代.若甲烷分子中的4个氢原子分别被苯基和氯原子取代,可得到 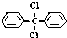 ,对该分子的描述,正确的是( )
,对该分子的描述,正确的是( )
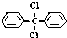 ,对该分子的描述,正确的是( )
,对该分子的描述,正确的是( )| A. | 此分子中存在着6种不同化学环境的氢原子 | |
| B. | 所有碳原子一定都在同一平面上 | |
| C. | 此分子难溶于水 | |
| D. | 此分子属芳香烃类物质 |
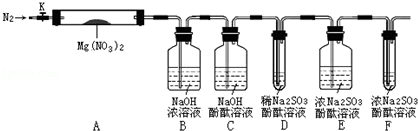
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.