题目内容
3.A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去).[A]$→_{反应①}^{+X一定条件}$[B]$→_{反应②}^{+X一定条件}$[C]
试回答:
(1)若X是强氧化性单质,则A不可能是de.
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为FeCl3;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)2Fe3++Fe=3Fe2+,防止Fe2+被氧化成Fe3+.
(3)A还可以是氨气,氨气分子的空间构型是三角锥形.
分析 (1)若X是强氧化性单质,A可发生连续氧化,X可以为氧气,A可以为S或C、Na或N2;
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则X为Fe,A为Cl2,B为FeCl3,C为FeCl2;
(3)氨气分子空间构型为三角锥形.
解答 (1)若X是强氧化性单质,A可发生连续氧化,X可以为氧气,A可以为S或C、Na或N2,不能为Mg、Al,故选:de;
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则X为Fe,A为Cl2,B为FeCl3,C为FeCl2,保存氯化亚铁加入少量Fe是因:2Fe3++Fe=3Fe2+,防止Fe2+被氧化成Fe3+,
故答案为:FeCl3;2Fe3++Fe=3Fe2+,防止Fe2+被氧化成Fe3+;
(3)氨气分子中N原子形成3个N-H键、含有一对孤电子对,故为三角锥形,故答案为:三角锥形.
点评 本题考查无机物的推断,基本属于开放性题目,需要学生熟练掌握元素化合物知识,题目难度中等.

练习册系列答案
相关题目
13.下列各表述与示意图一致的是( )
| A. | 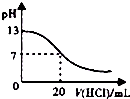 如图表示室温时,用0.1 mol.L-1 盐酸滴定0.1 mol•L-1NaOH溶液过程中的pH变化 | |
| B. | 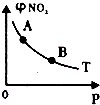 T℃时,反应2NO2(g)  N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 | |
| C. | 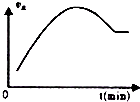 如图表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g)?2C(g)达到平衡,正反应速率随时间变化的示意图.由图可得出的结论是:反应物的总能量低于生成物的总量 | |
| D. | 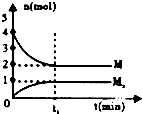 如图在恒温恒容的密闭容器中,气体M存在如下关系xM(g)?Mx(g),t1时刻,保持温度不变,再充入1mol M,重新达到平衡时$\frac{c(Mx)}{c(M)}$将增大 |
14.在标准状况下,112mL某气体的质量为0.16g,该气体可能是( )
| A. | O2 | B. | N2 | C. | H2S | D. | CO2 |
11.某溶液由Mg2+、Al3+、Cl-、SO${\;}_{4}^{2-}$4种离子组成,测得其中Al3+、SO${\;}_{4}^{2-}$、Cl-的物质的量浓度之比为3:1:13,则溶液中Mg2+、Al3+、SO${\;}_{4}^{2-}$的物质的量浓度之比为( )
| A. | 1:3:3 | B. | 3:1:3 | C. | 3:3:1 | D. | 2:1:3 |
18.下列操作中不正确的是 ( )
| A. | 加热试管内物质时,试管底部与酒精灯外焰接触 | |
| B. | 过滤时,漏斗下方紧贴烧杯内壁 | |
| C. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| D. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 |
8.下列叙述正确的是( )
| A. | pH=2的硫酸溶液中c(H+):c(OH-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中:K+、Ba2+、Cl-、Br-、一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8 | |
| D. | 某温度下水的离子积为1.0×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为10:1 |
13.在化学反应A+B=C+D中,若12gA与适量的B恰好完全反应,生成28gC和2gD,则参加反应的B的质量为( )
| A. | 8g | B. | 18g | C. | 28g | D. | 30g |