题目内容
14.在标准状况下,112mL某气体的质量为0.16g,该气体可能是( )| A. | O2 | B. | N2 | C. | H2S | D. | CO2 |
分析 根据n=$\frac{V}{{V}_{m}}$计算气体物质的量,再根据M=$\frac{m}{n}$计算气体相对分子质量,结合选项判断.
解答 解:在标准状况下,112mL 气体的物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,则该气体可能的摩尔质量为$\frac{0.16g}{0.005mol}$=32g/mol,故相对分子质量为32,选项中只有氧气相对分子质量为32,故选:A.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的计算,掌握相对分子质量的有关计算方法.

练习册系列答案
相关题目
4.下列有关实验的描述不正确的是( )
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | Mg在CO2中燃烧生成MgO和C,在该反应条件下,Mg的还原性强于C的还原性 |
2.下列说法正确的是( )
| A. | 胶体区别于其他分散系的本质依据是具有丁达尔效应 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体粒子也一定会向某一极移动 | |
| C. | 纳米材料粒子直径一般在10-9m与10-7m之间,因此纳米材料属于胶体 | |
| D. | 在江河入海处容易形成沙洲与胶体的聚沉有关 |
9.碱性电池具有容量大,放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH,下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2+2H2O+2e-═2MnOOH+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2mol 电子,锌的质量理论上减少6.5g |
19.下列离子方程式书写不正确的是( )
①铝溶于稀硫酸中:Al+2H+═Al3++H2↑
②将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑
③用食醋除去热水瓶中的水垢:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O
④氯化钙与碳酸氢钾溶液反应:Ca2++CO32-═CaCO3↓
①铝溶于稀硫酸中:Al+2H+═Al3++H2↑
②将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑
③用食醋除去热水瓶中的水垢:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O
④氯化钙与碳酸氢钾溶液反应:Ca2++CO32-═CaCO3↓
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ③ |
4.在101kPa时,测得氢气燃烧的热化学方程表示式如下:
①2H2(g)+02(g)=2H20(1)△H=-571.6kJ/mol
②2H2(g)+02(g)═2H20(g)△H=-483.6kJ/mol
则H2的燃烧热为( )
①2H2(g)+02(g)=2H20(1)△H=-571.6kJ/mol
②2H2(g)+02(g)═2H20(g)△H=-483.6kJ/mol
则H2的燃烧热为( )
| A. | -285.8kJ/mol | B. | 285.8kJ/mol | C. | -241.8 kJ/mol | D. | 241.8kJ/md |
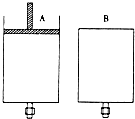 有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:
有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应: 和一个-Cl,它的可能结构有四种,请写出这四种可能的结构简式:
和一个-Cl,它的可能结构有四种,请写出这四种可能的结构简式: .
.