题目内容
 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属单质、NO2和O2.
2KNO3
| ||
2Cu(NO3)2
| ||
2AgNO3
| ||
实验一:探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将其溶于足
量的稀H2SO4得到相应两份溶液,进行以下探究实验.
提出猜想:猜想一:Fe元素只显+2价;
猜想二:Fe元素只显+3价;
猜想三:Fe元素
实验操作:①向一份溶液中滴入KSCN溶液②将稀酸性KMnO4溶液中滴入另一份溶液
实验现象:实验①
实验结论:猜想二成立,则Fe(NO3)2分解的化学方程式是
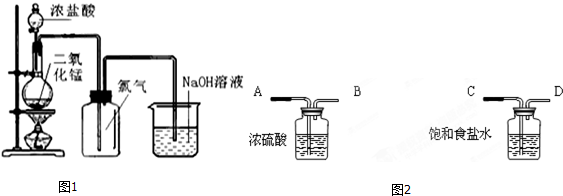
实验二:探究Fe(NO3)2热分解气体产物的性质.小组乙、丙同学进行了如图所示的实验(收集时操作恰当,几乎没有空气)
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重
新连接好仪器;④加热;⑤…
(1)乙同学使用A装置收集气体,恰好收集到常温常压下27mL的红棕色气体,为确保数据的准确性,读数时必须
(2)乙同学用带火星木条检验量筒内气体时,发现木条燃烧,且颜色变浅甚至无色,下列判断中正确的是
a.气体中只有NO2 b.气体是O2、NO2的混合物 c.支持燃烧的气体只有O2 d.NO2支持燃烧
(3)丙同学取等质量的Fe(NO3)2使用B装置收集气体,可收集到
实验三:探究固体混合物的成分.小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后
用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是
A.1:2:2 B.2:1:3 C.1:2:3 D.3:8:6.
考点:性质实验方案的设计
专题:实验设计题
分析:【实验一】
猜想三:Fe是典型的变价金属,有+2价、+3价,分解后,Fe可能只显+2价,可能只显+3价,也可能既有+2价也有+3价;
实验现象:检验铁离子用KSCN溶液,观察是否溶液变红,检验亚铁离子可用酸性KMnO4稀溶液,观察KMnO4溶液是否褪色;
实验结论:猜想二成立,Fe(NO3)2热分解生成了氧化铁,二氧化氮和氧气,方程式:4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑;
【实验二】
(1)使用A装置收集气体,恰好收集到常温常压下27mL的红棕色气体,为确保数据的准确性,读数时必须调节量筒,使量筒液面与水槽液面在同一高度;
(2)带火星木条检验量筒内气体时,发现木条燃烧,说明有氧气,且颜色变浅甚至无色,说明二氧化氮消耗并且能支持燃烧;
(3)由4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑可知产生NO2和O2的体积比为8:1,而4NO2~O2可恰好进入溶液中,剩余的NO2溶于水产生NO,因此收集到的气体为NO;
【实验三】
根据三个反应2KNO3
2KNO2↑+O2↑;2Cu(NO3)2
2CuO+4NO2↑+O2↑; 2Fe(NO3)2
Fe2O3+8NO2↑+O2↑,混合粉末充分加热后用排水法未收集到任何气体,说明三个反应中生成的气体物质的量之比n(NO2):n(O2)=4:1,通过选项答案验证;
按C选项,KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比1:2:2,则1 mol混合物中,n(NO3-)=(0.2+0.4×2+0.4×2)mol=1.8mol,根据3Cu~2NO3-~8H+关系计算Cu的质量.
猜想三:Fe是典型的变价金属,有+2价、+3价,分解后,Fe可能只显+2价,可能只显+3价,也可能既有+2价也有+3价;
实验现象:检验铁离子用KSCN溶液,观察是否溶液变红,检验亚铁离子可用酸性KMnO4稀溶液,观察KMnO4溶液是否褪色;
实验结论:猜想二成立,Fe(NO3)2热分解生成了氧化铁,二氧化氮和氧气,方程式:4Fe(NO3)2
| ||
【实验二】
(1)使用A装置收集气体,恰好收集到常温常压下27mL的红棕色气体,为确保数据的准确性,读数时必须调节量筒,使量筒液面与水槽液面在同一高度;
(2)带火星木条检验量筒内气体时,发现木条燃烧,说明有氧气,且颜色变浅甚至无色,说明二氧化氮消耗并且能支持燃烧;
(3)由4Fe(NO3)2
| ||
【实验三】
根据三个反应2KNO3
| ||
| ||
| ||
按C选项,KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比1:2:2,则1 mol混合物中,n(NO3-)=(0.2+0.4×2+0.4×2)mol=1.8mol,根据3Cu~2NO3-~8H+关系计算Cu的质量.
解答:
解:【实验一】
猜想三:Fe是典型的变价金属,有+2价、+3价,分解后,Fe可能只显+2价,可能只显+3价,也可能既有+2价也有+3价,
故答案为:既有+2价又有+3价;
实验现象:检验铁离子用KSCN溶液,观察是否溶液变红,检验亚铁离子可用酸性KMnO4稀溶液,观察KMnO4溶液是否褪色,
故答案为:①溶液呈血红色;②酸性KMnO4溶液不褪色;
实验结论:猜想二成立,Fe(NO3)2热分解生成了氧化铁,二氧化氮和氧气,方程式:4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑,
故答案为:4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑;
【实验二】
(1)使用A装置收集气体,恰好收集到常温常压下27mL的红棕色气体,为确保数据的准确性,读数时必须调节量筒,使量筒液面与水槽液面在同一高度,故答案为:调节量筒,使量筒液面与水槽液面在同一高度;
(2)带火星木条检验量筒内气体时,发现木条燃烧,说明有氧气,且颜色变浅甚至无色,说明二氧化氮消耗并且能支持燃烧,所以选bd;
故选:bd;
(3)若用排水法收集时,4NO2~O2可恰好进入溶液中,由4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑可知产生NO2和O2的体积比为8:1,则27ml气体中有12ml NO2和3ml O2恰好进入溶液,另外12ml NO2溶于水产生4ml NO,则收集到的气体为4ml 气体,
故答案为:4;
【实验三】根据三个反应2KNO3
2KNO2↑+O2↑;2Cu(NO3)2
2CuO+4NO2↑+O2↑; 2Fe(NO3)2
Fe2O3+8NO2↑+O2↑,混合粉末充分加热后用排水法未收集到任何气体,说明三个反应中生成的气体物质的量之比n(NO2):n(O2)=4:1,Cu(NO3)2受热分解的气体产物恰好符合物质的量之比n(NO2):n(O2)=4:1,所以其量为任意值,而KNO3和2Fe(NO3)2按物质的量比为1:2混合受热分解的气体恰好符合n(NO2):n(O2)=4:1进入溶液,
故答案为:AD.
猜想三:Fe是典型的变价金属,有+2价、+3价,分解后,Fe可能只显+2价,可能只显+3价,也可能既有+2价也有+3价,
故答案为:既有+2价又有+3价;
实验现象:检验铁离子用KSCN溶液,观察是否溶液变红,检验亚铁离子可用酸性KMnO4稀溶液,观察KMnO4溶液是否褪色,
故答案为:①溶液呈血红色;②酸性KMnO4溶液不褪色;
实验结论:猜想二成立,Fe(NO3)2热分解生成了氧化铁,二氧化氮和氧气,方程式:4Fe(NO3)2
| ||
故答案为:4Fe(NO3)2
| ||
【实验二】
(1)使用A装置收集气体,恰好收集到常温常压下27mL的红棕色气体,为确保数据的准确性,读数时必须调节量筒,使量筒液面与水槽液面在同一高度,故答案为:调节量筒,使量筒液面与水槽液面在同一高度;
(2)带火星木条检验量筒内气体时,发现木条燃烧,说明有氧气,且颜色变浅甚至无色,说明二氧化氮消耗并且能支持燃烧,所以选bd;
故选:bd;
(3)若用排水法收集时,4NO2~O2可恰好进入溶液中,由4Fe(NO3)2
| ||
故答案为:4;
【实验三】根据三个反应2KNO3
| ||
| ||
| ||
故答案为:AD.
点评:本题考查了铁及其重要化合物的性质实验方案设计,侧重于离子检验、设计实验方案及操作、混合物的计算,综合性较强,难度较大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列反应中,水既不是氧化剂,又不是还原剂的是( )
| A、2Na+2H2O=2NaOH+H2↑ |
| B、2F2+2H2O=4HF+O2 |
| C、NaH+H2O=NaOH+H2↑( NaH中H为-1价) |
| D、Cl2+H2O=HCl+HClO |
下列实验操作中错误的是( )
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处,且冷凝水方向应当由下往上 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、提取碘水中的碘单质时,应选择有机萃取剂,且萃取剂与水不互溶 |
 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)