题目内容
实验室常用氧化浓盐酸的方法制取氯气,课本中实验装置如图1:
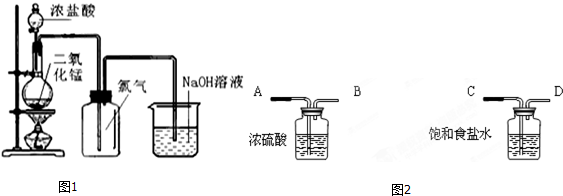
(1)写出制氯气的化学方程式: ,
(2)甲同学认为该装置制得的氯气不纯,在收集氯气之前补充了如图2的实验装置,你认为如何连接(用ABCD字母连接): .浓硫酸的作用 ,饱和食盐水的作用是 .

(1)写出制氯气的化学方程式:
(2)甲同学认为该装置制得的氯气不纯,在收集氯气之前补充了如图2的实验装置,你认为如何连接(用ABCD字母连接):
考点:氯气的实验室制法
专题:实验题
分析:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
(2)依据氯化氢受热易挥发、易溶于水,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性解答.
(2)依据氯化氢受热易挥发、易溶于水,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性解答.
解答:
解:(1)实验室通常用二氧化锰氧化浓盐酸反应制取氯气,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)氯化氢和水蒸气在加热时容易挥发,从发生装置出来的氯气含有杂质氯化氢、水,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性,将混合气体通入盛有饱和食盐水的洗气瓶可以除去氯化氢,然后通过盛有浓硫酸的洗气瓶,除去氯气中的水蒸气,
故答案为:CDBA;干燥氯气;除去氯气中的氯化氢.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)氯化氢和水蒸气在加热时容易挥发,从发生装置出来的氯气含有杂质氯化氢、水,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性,将混合气体通入盛有饱和食盐水的洗气瓶可以除去氯化氢,然后通过盛有浓硫酸的洗气瓶,除去氯气中的水蒸气,
故答案为:CDBA;干燥氯气;除去氯气中的氯化氢.
点评:本题考查了氯气的实验室制法,题目难度不大,明确反应的原理、氯气的性质是解题关键,注意除杂的先后顺序,为易错点.

练习册系列答案
相关题目
已知下列反应能够发生:
①2Fe2++Br2=2Fe3++2Br-
②2Fe3++2I-=2Fe2++I2
③2MnO4-+16H++10Br-=2Mn2++5Br2+8H2O
④I2+SO2+2H2O=4H++SO42-+2I-
据此,判断出氧化性由强到弱的正确顺序是( )
①2Fe2++Br2=2Fe3++2Br-
②2Fe3++2I-=2Fe2++I2
③2MnO4-+16H++10Br-=2Mn2++5Br2+8H2O
④I2+SO2+2H2O=4H++SO42-+2I-
据此,判断出氧化性由强到弱的正确顺序是( )
| A、MnO4->Fe3+>Br2>I2>SO2 |
| B、MnO4->Br2>Fe3+>I2>SO2 |
| C、MnO4->Br2>Fe3+>SO2>I2 |
| D、Br2>MnO4->Fe3+>I2>SO2 |
下列氯化物中,不能用金属单质和氯气直接反应制得的是( )
| A、CuCl2 |
| B、FeCl2 |
| C、MgCl2 |
| D、NaCl |
某溶液中有NH4+、Mg2+、Fe2+ 和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的离子是( )
| A、NH4+、Mg2+ |
| B、Fe2+、Mg2+ |
| C、Fe2+、NH4+ |
| D、Al3+、Fe2+ |
下列各组物质中,所含分子数相同的是( )
| A、18g H2O和14g N2 |
| B、5.6L O2和11g CO2 |
| C、9g H2O和0.5mol CO |
| D、224mL H2(标准状况)和0.1mol N2 |
 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.