题目内容
 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)称取粗盐
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
(1)判断SO42-已除尽的方法是
(2)操作②为什么不用Ba(NO3)2溶液?其理由是
(3)第③步中,相关的离子方程式是
第⑥步中,相关的离子方程式是
(4)实验室进行⑦步NaCl溶液蒸发时.一般有以下操作过程①放上蒸发皿(蒸发皿中盛有NaCl溶液);②固定铁圈位置;③放置酒精灯;④加热搅拌;⑤停止加热.其正确的操作顺序为
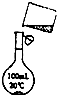
(5)为检验精盐纯度,需配制250mL0.2mol/LNaCl(精盐)溶液,如图是该同学转移溶液的示意图,图中的错误是
考点:物质分离、提纯的实验方案设计
专题:实验设计题
分析:(1)可用氯化钡检验SO42-;
(2)除杂时应避免引入新杂质;
(3)第③步中反应生成氢氧化镁,第⑥步中加入适量盐酸和除去氢氧化钠和碳酸钠;
(4)实验时,安装仪器应先下后上,先左后右;
(5)配制溶液时,所用容量瓶应与所配溶液体积相近,且用玻璃棒引流.
(2)除杂时应避免引入新杂质;
(3)第③步中反应生成氢氧化镁,第⑥步中加入适量盐酸和除去氢氧化钠和碳酸钠;
(4)实验时,安装仪器应先下后上,先左后右;
(5)配制溶液时,所用容量瓶应与所配溶液体积相近,且用玻璃棒引流.
解答:
解:(1)可用氯化钡检验SO42-,可取第②步后的上层溶液少许于试管中,再继续滴入氯化钡溶液,若溶液未变浑浊,则表明SO42-已除尽,
故答案为:取第②步后的上层溶液少许于试管中,再继续滴入氯化钡溶液,若溶液未变浑浊,则表明SO42-已除尽;
(2)除杂时应避免引入新杂质,如用Ba(NO3)2溶液,会引入NO3-杂质不易除去,故答案为:会引入NO3-杂质不易除去;
(3)第③步中反应生成氢氧化镁,离子方程式为Mg2++2OH-═Mg(OH)2↓,第⑥步中加入适量盐酸和除去氢氧化钠和碳酸钠,反应的离子方程式为OH-+H+=H2O、CO32-+2H+=H2O+CO2↑,
故答案为:Mg2++2OH-═Mg(OH)2↓;OH-+H+=H2O、CO32-+2H+=H2O+CO2↑;
(4)实验时,安装仪器应先下后上,先左后右,正确顺序为③②①④⑤,故答案为:③②①④⑤;
(5)配制溶液时,所用容量瓶应与所配溶液体积相近,即用250mL容量瓶配制,且用玻璃棒引流,故答案为:未用玻璃棒引流,未采用250mL容量瓶.
故答案为:取第②步后的上层溶液少许于试管中,再继续滴入氯化钡溶液,若溶液未变浑浊,则表明SO42-已除尽;
(2)除杂时应避免引入新杂质,如用Ba(NO3)2溶液,会引入NO3-杂质不易除去,故答案为:会引入NO3-杂质不易除去;
(3)第③步中反应生成氢氧化镁,离子方程式为Mg2++2OH-═Mg(OH)2↓,第⑥步中加入适量盐酸和除去氢氧化钠和碳酸钠,反应的离子方程式为OH-+H+=H2O、CO32-+2H+=H2O+CO2↑,
故答案为:Mg2++2OH-═Mg(OH)2↓;OH-+H+=H2O、CO32-+2H+=H2O+CO2↑;
(4)实验时,安装仪器应先下后上,先左后右,正确顺序为③②①④⑤,故答案为:③②①④⑤;
(5)配制溶液时,所用容量瓶应与所配溶液体积相近,即用250mL容量瓶配制,且用玻璃棒引流,故答案为:未用玻璃棒引流,未采用250mL容量瓶.
点评:本题考查了粗盐提纯的实验方法的分析判断,试剂的选择应用,为高频考点,侧重于学生的分析、实验能力的考查,注意试剂加入顺序和过量试剂的除去,题目难度中等.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式的是( )
| A、将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B、CuSO4溶液中加入少量Ba(OH)2溶液:SO42-+Ba2+=BaSO4 |
| C、将Cu丝插入AgNO3溶液中:Cu+Ag+=Cu2++Ag |
| D、用小苏打NaHCO3治疗胃酸过多:HCO3-+H+=H2O+CO2↑ |
生活中处处有化学,下列有关说法正确的是( )
| A、天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 |
| B、食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯 |
| C、保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
| D、地沟油分子中碳原子数过多,相对分子质量过大是地沟油不宜直接用作燃料油的原因之一 |
化学电池可以直接将化学能转化为电能,化学电池的本质是( )
| A、化合价的升降 |
| B、电子的转移 |
| C、氧化还原反应 |
| D、电能的储存 |
已知下列反应能够发生:
①2Fe2++Br2=2Fe3++2Br-
②2Fe3++2I-=2Fe2++I2
③2MnO4-+16H++10Br-=2Mn2++5Br2+8H2O
④I2+SO2+2H2O=4H++SO42-+2I-
据此,判断出氧化性由强到弱的正确顺序是( )
①2Fe2++Br2=2Fe3++2Br-
②2Fe3++2I-=2Fe2++I2
③2MnO4-+16H++10Br-=2Mn2++5Br2+8H2O
④I2+SO2+2H2O=4H++SO42-+2I-
据此,判断出氧化性由强到弱的正确顺序是( )
| A、MnO4->Fe3+>Br2>I2>SO2 |
| B、MnO4->Br2>Fe3+>I2>SO2 |
| C、MnO4->Br2>Fe3+>SO2>I2 |
| D、Br2>MnO4->Fe3+>I2>SO2 |
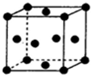 A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液先变红后褪色.据此回答下列问题:
A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液先变红后褪色.据此回答下列问题:
 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.