题目内容
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂.
(1)工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为
(2)漂白粉的有效成份是(填化学式) .
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) .
(1)工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为
(2)漂白粉的有效成份是(填化学式)
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)
考点:氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:(1)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(2)漂白粉的有效成份是次氯酸钙;
(3)次氯酸钙与二氧化碳反应生成次氯酸和碳酸钙;
(4)根据元素化合价是否发生变化判断是否属于氧化还原反应.
(2)漂白粉的有效成份是次氯酸钙;
(3)次氯酸钙与二氧化碳反应生成次氯酸和碳酸钙;
(4)根据元素化合价是否发生变化判断是否属于氧化还原反应.
解答:
解:(1)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)漂白粉的有效成份是次氯酸钙,化学式为Ca(ClO)2,故答案为:Ca(ClO)2;
(3)次氯酸钙与二氧化碳反应生成次氯酸和碳酸钙,反应的方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(4)以上反应中,(1)中存在元素化合价的变化,属于氧化还原反应,故答案为:(1).
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)漂白粉的有效成份是次氯酸钙,化学式为Ca(ClO)2,故答案为:Ca(ClO)2;
(3)次氯酸钙与二氧化碳反应生成次氯酸和碳酸钙,反应的方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(4)以上反应中,(1)中存在元素化合价的变化,属于氧化还原反应,故答案为:(1).
点评:本题考查漂白粉的制备及漂白原理,把握氯气的性质、次氯酸钙的性质、HClO的性质为解答的关键,明确发生的化学反应即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
化学电池可以直接将化学能转化为电能,化学电池的本质是( )
| A、化合价的升降 |
| B、电子的转移 |
| C、氧化还原反应 |
| D、电能的储存 |
为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
| A、将大小、形状相同的镁条和铝条与同浓度、同温度下的盐酸反应时,两者快慢相同 |
| B、盛有相同浓度的双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 |
| C、将浓硝酸分别放在的冷暗处和强光,发现强光下的浓硝酸分解得快 |
| D、将相同浓度Na2S2O2溶液与硫酸溶液混合,升高温度后溶液出现浑浊的时间变短,原因是反应物分子的能量增加,单位体积内活化分子百分数增大,有效碰撞次数增 |
一定温度下,向2.0L恒容密闭容器中充入1.0mol COCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前2 s 的平均速率v(CO)=0.080mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(Cl2)=0.11 mol?L-1,则正反应为放热反应 |
| C、向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆 |
| D、若起始向容器中充入1.0 mol Cl2 和0.9 mol CO,达到平衡时,Cl2的转化率大于80% |
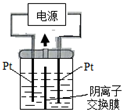 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O,下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O,下列说法不正确的是( )| A、右侧发生的电极方程式:2H2O+2e-═H2↑+2OH- |
| B、电解结束时,右侧溶液中含有IO3- |
| C、电解槽内发生反应的总化学方程式KI+3H2O═KIO3+3H2 |
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
已知下列反应能够发生:
①2Fe2++Br2=2Fe3++2Br-
②2Fe3++2I-=2Fe2++I2
③2MnO4-+16H++10Br-=2Mn2++5Br2+8H2O
④I2+SO2+2H2O=4H++SO42-+2I-
据此,判断出氧化性由强到弱的正确顺序是( )
①2Fe2++Br2=2Fe3++2Br-
②2Fe3++2I-=2Fe2++I2
③2MnO4-+16H++10Br-=2Mn2++5Br2+8H2O
④I2+SO2+2H2O=4H++SO42-+2I-
据此,判断出氧化性由强到弱的正确顺序是( )
| A、MnO4->Fe3+>Br2>I2>SO2 |
| B、MnO4->Br2>Fe3+>I2>SO2 |
| C、MnO4->Br2>Fe3+>SO2>I2 |
| D、Br2>MnO4->Fe3+>I2>SO2 |
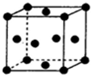 A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液先变红后褪色.据此回答下列问题:
A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液先变红后褪色.据此回答下列问题: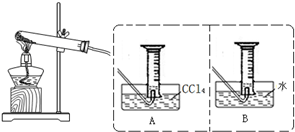 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查阅资料:金属活泼性不同,其硝酸盐分解产物不同.