题目内容
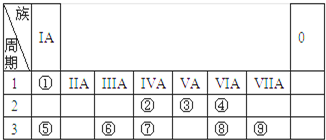
 短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.
短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.(1)写出W的原子结构示意图:
(2)将足量X的最高价氧化物通入含Y元素的阴离子溶液中.反应的离子方程式为
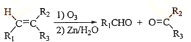
(3)已知:X(s)+O2(g)═XO2(g)△H=-393.5kJ?mol-1
H2(g)+
| 1 |
| 2 |
XH4(g)+2O2(g)═XO2(g)+2H2O(g)△H=-802.0kJ?mol-1
则XH4气体分解成氢气和X固体的热化学方程式为
(4)ZO是由单质X和ZO2反应制取单质Z的中间产物.隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为
(5)利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物.写出该电池负极反应式:
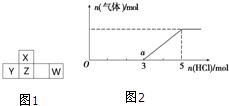
(6)将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图2所示(忽略气体的溶解和HCl的挥发).
①O点溶液中所含溶质的化学式为
②a点溶液中,c(Na+):c(Cl-)=
考点:位置结构性质的相互关系应用,化学方程式的有关计算,热化学方程式,电解原理
专题:化学反应中的能量变化,元素周期律与元素周期表专题,电化学专题
分析:W的氧化物是酸雨形成的主要物质,则W为S元素,由四种元素在周期表中的位置可知X为C元素,Y为Al元素,Z为Si元素,
(1)W为S元素,原子核外有3个电子层,最外层电子数为6,以此书写原子结构示意图;
(2)反应为CO2与AlO2-溶液的反应;
(3)利用盖斯定律计算;
(4)SiO在氢氧化钠溶液中自身发生氧化还原反应生成Si和Na2SiO3;
(5)负极发生氧化反应,SO2被氧化生成H2SO4;
(6)a点时反应为NaHS+HCl=H2S+NaCl,由横坐标数值可知0点时溶质为NaOH和Na2S,以此进行计算.
(1)W为S元素,原子核外有3个电子层,最外层电子数为6,以此书写原子结构示意图;
(2)反应为CO2与AlO2-溶液的反应;
(3)利用盖斯定律计算;
(4)SiO在氢氧化钠溶液中自身发生氧化还原反应生成Si和Na2SiO3;
(5)负极发生氧化反应,SO2被氧化生成H2SO4;
(6)a点时反应为NaHS+HCl=H2S+NaCl,由横坐标数值可知0点时溶质为NaOH和Na2S,以此进行计算.
解答:
解:W的氧化物是酸雨形成的主要物质,则W为S元素,由四种元素在周期表中的位置可知X为C元素,Y为Al元素,Z为Si元素,
(1)W为S元素,原子核外有3个电子层,最外层电子数为6,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)反应为CO2与AlO2-溶液的反应,离子方程式为CO2+2H2O+AlO2-═Al(OH)3↓+HCO3-,
故答案为:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3-;
(3)已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
②H2(g)+
O2(g)═H2O(g)△H=-242.0kJ?mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.0kJ?mol-1,
利用盖斯定律将③-②×2-①可得CH4(g)=C(s)+2H2(g)
△H=(-802.0kJ?mol-1)-2×(-242.0kJ?mol-1)-(-393.5kJ?mol-1)=+75.5kJ?mol-1,
故答案为:CH4(g)=C(s)+2H2(g)△H=+75.5kJ?mol-1;
(4)SiO在氢氧化钠溶液中自身发生氧化还原反应生成Si和Na2SiO3,反应的化学方程式为2SiO+2NaOH=Si+Na2SiO3+H2O,
故答案为:2SiO+2NaOH=Si+Na2SiO3+H2O;
(5)负极发生氧化反应,SO2被氧化生成H2SO4,电极方程式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(6)a点时反应为NaHS+HCl=H2S+NaCl,由横坐标数值可知0点时溶质为NaOH和Na2S,0~a电发生反应为:
NaOH+HCl=NaCl、Na2S+HCl=NaHS+NaCl,因NaHS消耗2molHCl,则Na2S为2molNaOH为1mol,
①O点溶液中所含溶质的化学式为NaOH、Na2S,故答案为:NaOH、Na2S;
②由以上分析可知,0~a电发生反应为:NaOH+HCl=NaCl、Na2S+HCl=NaHS+NaCl,
1mol 1mol 2mol 2mol 2mol
则a点溶液中,c(Na+):c(Cl-)=5mol:3mol=5:3,
故答案为:5:3.
(1)W为S元素,原子核外有3个电子层,最外层电子数为6,原子结构示意图为
 ,故答案为:
,故答案为: ;
;(2)反应为CO2与AlO2-溶液的反应,离子方程式为CO2+2H2O+AlO2-═Al(OH)3↓+HCO3-,
故答案为:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3-;
(3)已知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
②H2(g)+
| 1 |
| 2 |
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.0kJ?mol-1,
利用盖斯定律将③-②×2-①可得CH4(g)=C(s)+2H2(g)
△H=(-802.0kJ?mol-1)-2×(-242.0kJ?mol-1)-(-393.5kJ?mol-1)=+75.5kJ?mol-1,
故答案为:CH4(g)=C(s)+2H2(g)△H=+75.5kJ?mol-1;
(4)SiO在氢氧化钠溶液中自身发生氧化还原反应生成Si和Na2SiO3,反应的化学方程式为2SiO+2NaOH=Si+Na2SiO3+H2O,
故答案为:2SiO+2NaOH=Si+Na2SiO3+H2O;
(5)负极发生氧化反应,SO2被氧化生成H2SO4,电极方程式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(6)a点时反应为NaHS+HCl=H2S+NaCl,由横坐标数值可知0点时溶质为NaOH和Na2S,0~a电发生反应为:
NaOH+HCl=NaCl、Na2S+HCl=NaHS+NaCl,因NaHS消耗2molHCl,则Na2S为2molNaOH为1mol,
①O点溶液中所含溶质的化学式为NaOH、Na2S,故答案为:NaOH、Na2S;
②由以上分析可知,0~a电发生反应为:NaOH+HCl=NaCl、Na2S+HCl=NaHS+NaCl,
1mol 1mol 2mol 2mol 2mol
则a点溶液中,c(Na+):c(Cl-)=5mol:3mol=5:3,
故答案为:5:3.
点评:本题考查较为综合,涉及元素周期律、周期表的关系、盖斯定律的应用、氧化还原反应的计算以及化学方程式的计算等,为高频考点,侧重于学生的分析能力、计算能力的考查,难度中等.

练习册系列答案
相关题目
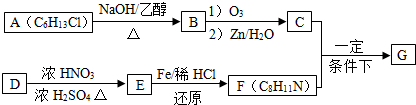
以石油为原料可进行如下转化.下列说法正确的是( )
石油→乙烯→乙醇→乙酸→乙酸乙酯.
石油→乙烯→乙醇→乙酸→乙酸乙酯.
| A、石油通过分馏可直接得到乙烯 |
| B、乙烯、聚乙烯的最简式均为CH2,二者互为同分异构体 |
| C、可用氢氧化钠溶液来区别乙醇和乙酸 |
| D、乙醇、乙酸和乙酸乙酯都能发生取代反应 |
下列电子式书写不正确的是( )
A、 |
B、 |
C、 |
D、 |