题目内容
1.锌元素与人的智力有密切关系,如ZnSO4•7H2O、ZnO等均具有药物价值.(1)工业上制备ZnSO4•7H2O的方法很多,可由粗ZnO(含Fe2+、Mn2+、Cd2+、Ni2+)通过以下流程完成:
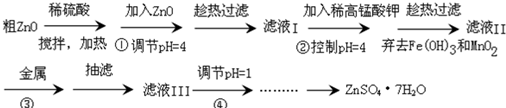
①试写出加入稀高锰酸钾溶液时的离子方程式MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
②流程③中的金属可以用C(填编号).
A.Na B.Al C.Zn D.Cu
③流程④中调pH=1目的为抑制Zn2+的水解.
(2)氧化锌的制备:取精制的硫酸锌溶液慢慢加入碳酸钠溶液,边加边搅拌使气体完全逸出,并使pH约为6.8左右,煮沸至沉淀析出,倾去上层清液,用热水洗涤到无SO42-为止,过滤干燥后得固体ZnCO3•2Zn(OH)2•2H2O转至仪器A中,煅烧至完全分解,冷却得固体ZnO.
①仪器A名称为坩埚.
②写出硫酸锌溶液中慢慢加入碳酸钠溶液时的化学方程式3ZnSO4+3Na2CO3+4H2O=ZnCO3•2Zn(OH)2•2H2O↓+3Na2SO4+2CO2↑.
③如何证明固体A已煅烧至完全分解?取少量煅烧的固体,加入稀硫酸,观察是否有气泡产生,若无气泡产生,说明已完全分解.
分析 工艺流程可知,步骤①粗ZnO与硫酸反应,通过搅拌可以加快反应速率,结合步骤④加入高锰酸钾,调节pH=4,有氢氧化铁、二氧化锰生成,根据控制的PH值及原子守恒、电荷守恒可知,都有水参加反应,同时还生成氢离子,④发生反应:MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+,故步骤②加入ZnO,调节溶液pH=4,是使溶液中一些离子转化为沉淀,由于锌离子水解,步骤⑥中调pH=1目的是抑制Zn2+的水解,再经过蒸发浓缩、降温结晶、过滤得到ZnSO4•7H2O.
(1)①由工艺流程可知,加入高锰酸钾有氢氧化铁、二氧化锰生成,应是高锰酸根氧化亚铁离子生成氢氧化铁、二氧化锰,高锰酸根氧化锰离子生成二氧化锰,根据控制的PH值及原子守恒、电荷守恒可知,都有水参加反应,同时还生成氢离子;
②流程③中加入金属的目的,应是除去溶液中金属离子,又不能引入杂质,应Ⅱ选择锌;
③锌离子水解,流程④中调pH=1目的是抑制Zn2+的水解;
(2)①煅烧固体,应用坩埚;
②反应生成ZnCO3•2Zn(OH)2•2H2O,生成的气体为二氧化碳,根据元素守恒可知,还有硫酸钠生成;
③检验煅烧后固体中是否含有碳酸根即可,可以与酸反应产生气体判断.
解答 解:(1)①由工艺流程可知,加入高锰酸钾有氢氧化铁、二氧化锰生成,应是高锰酸根氧化亚铁离子生成氢氧化铁、二氧化锰,高锰酸根氧化锰离子生成二氧化锰,根据控制的PH值及原子守恒、电荷守恒可知,都有水参加反应,同时还生成氢离子,反应的离子方程式为:MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+,
故答案为:MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+;2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
②流程③中加入金属的目的,应是除去溶液中金属离子,又不能引入杂质,应Ⅱ选择锌,故答案为:C;
③锌离子水解,流程④中调pH=1目的是抑制Zn2+的水解,故答案为:抑制Zn2+的水解;
(2)①煅烧固体,应用坩埚,故答案为:坩埚;
②反应生成ZnCO3•2Zn(OH)2•2H2O,生成的气体为二氧化碳,根据元素守恒可知,还有硫酸钠生成,反应方程式为:3ZnSO4+3Na2CO3+4H2O=ZnCO3•2Zn(OH)2•2H2O↓+3Na2SO4+2CO2↑,
故答案为:3ZnSO4+3Na2CO3+4H2O=ZnCO3•2Zn(OH)2•2H2O↓+3Na2SO4+2CO2↑;
③检验煅烧后固体中是否含有碳酸根即可,实验操作为:取少量煅烧的固体,加入稀硫酸,观察是否有气泡产生,若无气泡产生,说明已完全分解,
故答案为:取少量煅烧的固体,加入稀硫酸,观察是否有气泡产生,若无气泡产生,说明已完全分解.
点评 本题考查化学工艺流程流程、对信息的提取利用等,题目难度较大,理解工业流程是解题的关键,注意根据物质的性质梳理流程原理,需要学生具有扎实的基础与运用知识分子解决问题的能力.

 寒假学与练系列答案
寒假学与练系列答案| A. | 1.8 g | B. | 2.7 g | C. | 4.05g | D. | 5.4 g |
| A. | 肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-、MnO4- | |
| B. | 肯定存在的离子是SO32-、Br-;Na+、K+离子至少有一种存在 | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断有影响. |
| A. | 按系统命名法,化合物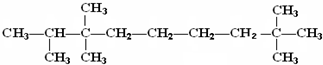 的名称为:2,3,3,8,8-五甲基壬烷 的名称为:2,3,3,8,8-五甲基壬烷 | |
| B. | 将少量溴水加入石油裂化得到的汽油中,溴水分层,上层为橙红色 | |
| C. | 往2ml10%的CuSO4溶液中加入5滴5%的NaOH溶液,再加入2ml10%的葡萄糖溶液,加热,得到砖红色的氧化亚铜沉淀 | |
| D. | 甲烷、乙醇、乙酸在一定条件下都能发生取代反应 |
| A. | A分子属于酯类化合物,在一定条件下能发生水解反应 | |
| B. | 符合题中A分子结构特征的有机物有两种 | |
| C. | A在一定条件下可与3 mol H2发生加成反应 | |
| D. | 分子式为C8H8O2且分子中含苯环和-COOR(-R为烃基)的物质共有6种 |
| A. | 萃取操作中,分液漏斗振摇后需要放气,放气的具体操作为,将分液漏斗置于铁架台的铁圈上,打开上口玻璃塞 | |
| B. | 燃料电池制作中,为了能吸附更多气体,在两根碳棒表面包上一层薄海绵 | |
| C. | 用硫代硫酸钠溶液和硫酸溶液反应测反应速率是实验中,可以通过判断气泡多少来比较反应速率快慢 | |
| D. | 酸碱中和滴定操作中,用酸润洗过的滴定管需要用蒸馏水再润洗一次 |
 A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):
A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去): .
.