题目内容
2.下列说法不正确的是( )| A. | 熟石灰与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| B. | 人造纤维是利用自然界的非纤维材料通过化学合成方法得到的 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” |
分析 A、熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏.利用石膏的这一性质,人们常利用各种模型和医疗上用的;
B、以天然纤维素纤维(树皮、纸浆、废棉纱)为原料熔融纺丝、纺纱制造的,都是人造纤维;石油化工为原料制造的,都是合成纤维;
C.雾分散剂是空气,分散质为灰尘颗粒,活性炭具有吸附作用;
D.白色污染是指不能降解的聚乙烯塑料.
解答 解:A、熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏.利用石膏的这一性质,人们常利用各种模型和医疗上用的,故A正确;
B.以天然纤维素纤维(树皮、纸浆、废棉纱)为原料熔融纺丝、纺纱制造的,都是人造纤维,以石油化工为原料制造的,都是合成纤维,故B错误;
C.具有吸附性,能吸附异味、有毒物质和色素等,带活性炭口罩防雾霾是利用了活性炭具有吸附性,能吸附可吸入性颗粒物等,是吸附原理,故C正确;
D.利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代不能降解的聚乙烯塑料,可减少白色污染,故D正确;
故选B.
点评 本题考查了石膏性质应用,人造纤维和合成纤维的定义,白色污染、雾霾的理解应用,注意知识的积累,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.甲、乙两烧杯中各盛有100mL 3mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=2:3,则加入铝粉的质量为( )
| A. | 1.8 g | B. | 2.7 g | C. | 4.05g | D. | 5.4 g |
13.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图.关于A的下列说法中,正确的是( )
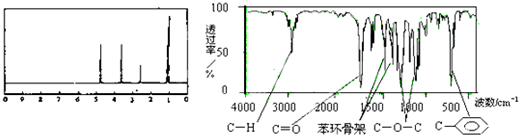

| A. | A分子属于酯类化合物,在一定条件下能发生水解反应 | |
| B. | 符合题中A分子结构特征的有机物有两种 | |
| C. | A在一定条件下可与3 mol H2发生加成反应 | |
| D. | 分子式为C8H8O2且分子中含苯环和-COOR(-R为烃基)的物质共有6种 |
17.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:
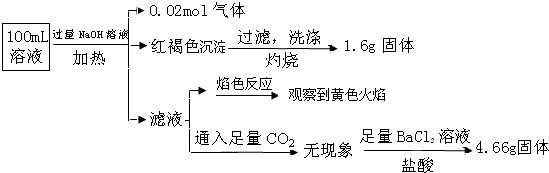
由此可知原溶液中( )

由此可知原溶液中( )
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
7.下列说法不正确的是( )
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,单晶硅可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | |
| C. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
| D. | 利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
14.Ⅰ.在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)?2Z(g),已知将2molX 和1molY充入该容器中,反应在绝热条件下达到平衡时,Z 的物质的量为pmol.回答下列问题:
(1)若把2molX 和1molY 充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的熵变△S< 0(填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤.

①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大 ⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如右上图所示.下列说法正确的是BD.
A.A、C 两点的反应速率:A>C
B.A、C 两点的气体密度:A<C
C.B、C 两点的气体的平均相对分子质量:B<C
D.由状态B 到状态A,可以用加热的方法
Ⅱ.(4)工业制取水煤气的过程中会伴随:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是AD.
A.2c1=c2=c3 B.2Q1=Q2=Q3 C.α1=α2=α3 D.α1+α2=1
(5)图3表示上述反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是升高温度,或增加水蒸汽的量,或减少氢气的量(写出一种).
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).
(1)若把2molX 和1molY 充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的熵变△S< 0(填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤.

①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大 ⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如右上图所示.下列说法正确的是BD.
A.A、C 两点的反应速率:A>C
B.A、C 两点的气体密度:A<C
C.B、C 两点的气体的平均相对分子质量:B<C
D.由状态B 到状态A,可以用加热的方法
Ⅱ.(4)工业制取水煤气的过程中会伴随:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是AD.
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
(5)图3表示上述反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是升高温度,或增加水蒸汽的量,或减少氢气的量(写出一种).
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).
11.下列关于实验的说法正确的是( )
| A. | 萃取操作中,分液漏斗振摇后需要放气,放气的具体操作为,将分液漏斗置于铁架台的铁圈上,打开上口玻璃塞 | |
| B. | 燃料电池制作中,为了能吸附更多气体,在两根碳棒表面包上一层薄海绵 | |
| C. | 用硫代硫酸钠溶液和硫酸溶液反应测反应速率是实验中,可以通过判断气泡多少来比较反应速率快慢 | |
| D. | 酸碱中和滴定操作中,用酸润洗过的滴定管需要用蒸馏水再润洗一次 |
12.下列物质中属于电解质的是( )
①氢氧化钾
②二氧化碳
③铜
④蔗糖
⑤碳酸钙.
①氢氧化钾
②二氧化碳
③铜
④蔗糖
⑤碳酸钙.
| A. | ①② | B. | ①②⑤ | C. | ③④ | D. | ①⑤ |
 A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):
A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去): .
.