题目内容
20.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,该反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O,反应类型为取代反应.
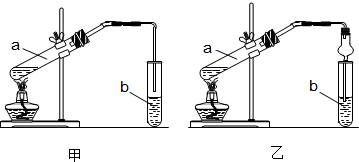
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:

【装置选择】若从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,选择的装置应是乙(填“甲”或“乙”).丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是防止倒吸.
【实验操作】
(1)在试管①中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是先在试管中加入一定量的乙醇,然后边加边振荡将浓硫酸慢慢注入试管中,最后再加入乙酸.
(2)在试管②中盛一定量的X试剂,该试剂是饱和碳酸钠溶液.
(3)按上述选择组装好装置,用酒精灯加热,过一会儿,在试管②中观察到的现象是液体分为两层,且能闻到香味.
【问题讨论】
(4)实验中浓硫酸的作用是催化剂和吸水剂.
(5)常用分液方法分离获得实验所得的乙酸乙酯.
分析 【装置选择】
乙醇、乙酸与浓硫酸混合共热发生取代反应生成乙酸乙酯和水;
甲装置导管直接插入液面以下容易发生倒吸;球形干燥管容积较大可以防止倒吸;
【实验操作】
(1)浓硫酸密度大,稀释产生大量的热,混合时应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
(2)乙醇、乙酸易挥发,制备的乙酸乙酯中含有乙醇和乙酸,乙醇易溶于水,乙酸能够与碳酸钠溶液反应,乙酸乙酯在饱和碳酸钠溶液中溶解度不大,所以可以用饱和碳酸钠溶液除去乙醇、乙酸,降低乙酸乙酯的溶解度;
(3)乙酸乙酯密度小于水,不溶于水,有芳香气味,据此判断现象;
(4)酯化反应中浓硫酸作用为:催化剂和吸水剂;
(5)分类两种相互不溶的液体用分液方法.
解答 解:【装置设计】
乙醇与乙酸在浓硫酸做催化剂、吸水剂条件下发生取代反应生成乙酸乙酯和水,方程式:
CH3COOH+CH3CH2OH $?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O;反应类型为:取代反应;
故答案为:CH3COOH+CH3CH2OH $?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O;取代反应;
甲装置导管直接插入液面以下容易发生倒吸;所以应选择乙装置;球形干燥管容积较大可以防止倒吸,
故答案为:乙;防止倒吸;
【实验操作】
(1)浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;添加顺序依次乙醇、浓硫酸、乙酸,正确的操作为:先在试管中加入一定量的乙醇,然后边加边振荡将浓硫酸慢慢注入试管中,最后再加入乙酸;
故答案为:先在试管中加入一定量的乙醇,然后边加边振荡将浓硫酸慢慢注入试管中,最后再加入乙酸;
(2)乙醇、乙酸易挥发,制备的乙酸乙酯中含有乙醇和乙酸,乙醇易溶于水,乙酸能够与碳酸钠溶液反应,方程式:2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O,乙酸乙酯在饱和碳酸钠溶液中溶解度不大,所以可以用饱和碳酸钠溶液除去乙醇、乙酸,降低乙酸乙酯的溶解度,所以在试管②中盛一定量的饱和碳酸钠溶液试剂,
故答案为:饱和碳酸钠溶液;
(3)乙酸乙酯密度小于水,不溶于水,有芳香气味,所以在试管②中观察到的现象是液体分为两层,且能闻到香味;
故答案为:液体分为两层,且能闻到香味;
(4)酯化反应中浓硫酸作用为:催化剂和吸水剂;
故答案为:催化剂和吸水剂;
(5)乙酸乙酯密度小于水,难溶于与水,加入饱和碳酸钠溶液后,二者分层,可以用分液法分离二者;
故答案为:分液;
点评 本题考查乙酸乙酯的制备,明确制备原理及实验装置特点是解题关键,注意实验的基本操作以及浓硫酸混合时的注意事项,易错点是球形干燥管的用途.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | 该反应为可逆反应,不可能进行到底,即乙醇的转化率一定达不到100% | |
| B. | 乙酸挥发,导致其量减少,乙醇过量,不能充分转化为乙酸乙酯 | |
| C. | 产物不稳定,易被氧化为其他物质而影响乙醇的转化率 | |
| D. | 馏出物导入饱和碳酸钠溶液液面上,有较多的乙酸乙酯溶解于水溶液中 |
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.| 物质 | 沸点/°C | 密度/g?cm-3 |
| 乙醇 | 78.0 | 0.79 |
| 乙酸 | 117.9 | 1.05 |
| 乙酸乙酯 | 77.5 | 0.90 |
| 异戊醇 | 131 | 0.8123 |
| 乙酸异戊酯 | 142 | 0.8670 |
①配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
②按图连接实验装置并检验气密性
③分别在试管1、试管2中加入反应液
④用酒精灯微热3min,再加热使之微微沸腾3min
⑤分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:碎瓷片(按着加入的先后顺序写出名称),乙醇过量的目的是:提高乙酸的转化率;
(2)该反应的平衡常数表达式K=$\frac{[C{H}_{3}COOC{H}_{2}C{H}_{3}][{H}_{2}O]}{[CH{\;}_{3}COOH][C{H}_{{\;}_{3}}C{H}_{2}OH]}$;
(3)试管Ⅱ中所盛试剂为饱和碳酸钠溶液,欲将其物质分离使用的仪器为分液漏斗,在充分振荡的过程中,发生的反应为2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验A、C(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动;
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中的得到,那么产率会低(“较高”或“偏低”).
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | 不反应 | 溶解 | 生成氢气 |
| B | 不反应 | 有银镜反应 | 有红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
ACH3CH2COOH BCH3CHOHCHO或CH2OHCH2CHOCHCOOCH2CH3 DCH3COOCH3.
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
C(石墨)+O2(g)═CO2 (g)△H=-393.5kJ•mol-1
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H为( )
| A. | 1 641.0 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
 Z(g)+W(s);△H>0,下列叙述正确的是
Z(g)+W(s);△H>0,下列叙述正确的是