题目内容
12.丙烯酸的结构简式为CH2=CH-COOH,下列关于丙烯酸的说法错误的是( )| A. | 丙烯酸可以发生取代反应 | |
| B. | 丙烯酸可以使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯酸与HBr发生加成反应只能得到唯一产物 | |
| D. | 丙烯酸钠溶液中Na+浓度大于丙烯酸根离子浓度 |
分析 CH2=CH-COOH含有C=C和-COOH,C=C可发生加成、加聚以及氧化反应,-COOH具有酸性,可发生酯化反应.
解答 解:A.含有羧基,可发生取代反应,如发生酯化反应,故A正确;
B.含有碳碳双键,可被酸性高锰酸钾氧化,故B正确;
C.结构不对称,与HBr发生加成反应可生成CH2BrCH2-COOH或CH3CHBr-COOH,故C错误;
D.CH2=CH-COOH为弱酸,丙烯酸钠水解呈碱性,溶液中Na+浓度大于丙烯酸根离子浓度,故D正确.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,注意把握有机物的官能团的结构和性质,为解答该类题目的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.化学与环境密切相关,下列有关说法正确的是( )
| A. | CO2属于大气污染物 | B. | 酸雨是PH小于7的雨水 | ||
| C. | CO2、NO2或SO2都会导致酸雨的形成 | D. | NO2造成光化学烟雾的主要因素 |
3.锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
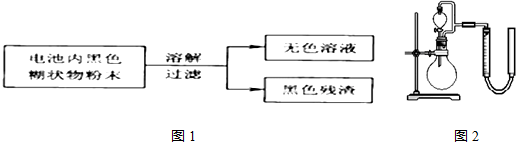
(1)锌锰干电池的电路中每通过0.2mole-,理论上负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
(2)某研究小组对电池内黑色糊状物进行了下列实验.
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图2所示.将等物质的量浓度、等体积H2O2溶液加入烧瓶中,分别进行2个实验(气体的体积在相同条件下测定).
实验1、2中参加反应的H2O2的物质的量之比为1:1,实验二中反应的离子方程式为H2O2+2H++MnO2═Mn2++2H2O+O2↑.

(1)锌锰干电池的电路中每通过0.2mole-,理论上负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
(2)某研究小组对电池内黑色糊状物进行了下列实验.
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀,白色沉淀逐渐溶解,产生刺激性气味的气体 | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |
7.四种多硼酸根离子的结构示意图如下,有关叙述正确的是( )


| A. | x=2 | B. | y=3 | ||
| C. | z=4 | D. | 图(d)的化学式为BO2 |
17.下列对烃的系统命名正确的是( )
| A. |  :5-甲基-2,4-己二烯 :5-甲基-2,4-己二烯 | B. |  1,2,3,4-四甲基环己烷 1,2,3,4-四甲基环己烷 | ||
| C. |  :1,3,4-三甲基苯 :1,3,4-三甲基苯 | D. |  :3-甲基-2-乙基戊烷 :3-甲基-2-乙基戊烷 |
4.工业上通过反应“SiO2(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$Si(s)+2CO”制取单质硅,下列说法正确的是( )
| A. | 自然界中硅元素均以SiO2形式存在 | |
| B. | 高纯度晶体Si可用于制造光导纤维 | |
| C. | 该反应条件下C的还原性比Si强 | |
| D. | 生成4.48LCO时转移电子数为0.4×6.02×1023 |
13. 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )| A. | 正反应为吸热反应 | B. | 平衡常数:KA>KB | ||
| C. | 反应速率:vB>vC | D. | W点时,v正>v逆 |