题目内容
17.碳的化合物与人类生产、生活密切相关.(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180℃-200℃}^{50-80℃}$Ni(CO)4(g).利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是CD(填字母编号).
A.把温度由80℃升高到180℃,正反应速率减小,逆反应速率增大
B.反应达到平衡后,充入Ni(CO)4(g)再次达到平衡时,$\frac{n[Ni(CO)_{4}]}{{n}^{4}(CO)}$减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当容器中混合气体密度不变时,可说明反应已达化学平衡状态
(2)图1所示的直形石英玻璃封管中充有CO气体,在温度为T1的一端放置不纯的镍(Ni)粉,Ni粉中的杂质不与CO(g)发生反应.在温度为T2的一端得到了纯净的高纯镍,则温度T1<T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是CO.
(3)甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、 2mol H2 | 1mol CH3OH | 2mol CO、 4mol H2 |
| CH3OH的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 反应物转化率 | α1 | α2 | α3 |
a.c1=c2 b.2Q1=Q3 c.Q1+Q2=90.8 d.α2+α3<100%
(4)据研究,上述(3)中合成甲醇反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是Cu2O+CO?2Cu+CO2(用化学方程式表示).
(5)已知在常温常压下:甲醇的燃烧热为725.8kJ•mol-1,CO的燃烧热为283kJ•mol-1,H2O(g)═H2O(l)△H=-44.0kJ•mol-1.写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ•mol-1.

(6)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳.如图2是四种金属氧化物(Cr2O3、SnO-1、PbO2、Cu2O)被一氧化碳还原时lg$\frac{c(CO)}{c(C{O}_{2})}$与温度(t)的关系曲线图.四个反应中属于吸热反应的是Cr2O3、SnO2(填金属氧化物的化学式),在700℃用一氧化碳还原Cr2O3时,若反应方程式化学计量数为最简整数比,该反应的平衡常数(K)数值等于10-12.
分析 (1)对于可逆反应,升高温度,正逆反应速率均加快,$\frac{n[Ni(CO)_{4}]}{{n}^{4}(CO)}$=K(平衡常数),因此温度不变,比值不变,反应达到平衡后,充入CO再次达到平衡时,相当于增大压强,平衡右移,CO的体积分数降低,Ni与CO反应,随反应的进行,气体质量增大,直到反应达到平衡,质量才不发生变化,根据公式ρ=m/V,容器容积V不变,密度ρ不变时,说明质量m不再变化,反应达到化学平衡状态;
(2)根据上述反应,在50~80℃,Ni与CO化合生成Ni(CO)4,在180~200℃分解生成Ni和CO,因此T1<T2,反应中CO可循环利用;
(3)根据反应特点可以确定,甲和乙可建立相同平衡状态,因此平衡时:c1=c2,Q1+Q2=90.8,α1+α2=100%.比较甲和丙,开始时丙中CO和H2浓度均为甲的2倍,相对于甲,丙相当于加压.假设甲和丙建立相同的平衡状态,则丙中放热是甲中的2倍,但加压平衡右移,因此Q3>2Q1,α3>α1,因此α2+α3>100%;
(4)反应中含有CO,CO会还原Cu2O,加入少量CO2,可使CO还原Cu2O反应逆向移动,保持Cu2O的量不变,反应为Cu2O+CO?2Cu+CO2;
(5)甲醇不完全燃烧生成一氧化碳和水蒸气的反应为CH3OH+O2═CO+2H2O.根据盖斯定律计算;
(6)用CO还原金属氧化物,反应的平衡常数K均可表示为$[\frac{c(C{O}_{2})}{c(CO)}]^{n}$,n>0,因此lg$\frac{c(C{O}_{2})}{c(CO)}$越小,则平衡常数越大.对于CO还原Cr2O3和SnO2,温度升高lg$\frac{c(C{O}_{2})}{c(CO)}$减小,则平衡常数增大,平衡正向移动,因此这两个反应为吸热反应,对于CO还原PbO2和Cu2O的反应为放热反应.
解答 解:(1)对于可逆反应,升高温度,正逆反应速率均加快,A错误.$\frac{n[Ni(CO)_{4}]}{{n}^{4}(CO)}$=K(平衡常数),因此温度不变,比值不变,B错误.反应达到平衡后,充入CO再次达到平衡时,相当于增大压强,平衡右移,CO的体积分数降低,C正确.Ni与CO反应,随反应的进行,气体质量增大,直到反应达到平衡,质量才不发生变化,根据公式ρ=m/V,容器容积V不变,密度ρ不变时,说明质量m不再变化,反应达到化学平衡状态,D正确;
故选CD;
(2)根据上述反应,在50~80℃,Ni与CO化合生成Ni(CO)4,在180~200℃分解生成Ni和CO,因此T1<T2,反应中CO可循环利用;
故答案为:<;CO;
(3)根据反应特点可以确定,甲和乙可建立相同平衡状态,因此平衡时:c1=c2,a正确;Q1+Q2=90.8,c正确;α1+α2=100%.比较甲和丙,开始时丙中CO和H2浓度均为甲的2倍,相对于甲,丙相当于加压.假设甲和丙建立相同的平衡状态,则丙中放热是甲中的2倍,但加压平衡右移,因此Q3>2Q1,b错误;α3>α1,因此α2+α3>100%,d错误;
故答案为:ac;
(4)反应中含有CO,CO会还原Cu2O,加入少量CO2,可使CO还原Cu2O反应逆向移动,保持Cu2O的量不变,反应为Cu2O+CO?2Cu+CO2;
故答案为:Cu2O+CO?2Cu+CO2;
(5)甲醇不完全燃烧生成一氧化碳和水蒸气的反应为CH3OH+O2═CO+2H2O.根据盖斯定律,反应CH3OH(l)+O2(g)═CO(g)+2H2O(g)的△H=-725.8 kJ•mol-1-
(-283 kJ•mol-1)-2×(-44.0 kJ•mol-1)=-354.8 kJ•mol-1;
故答案为:CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8 kJ•mol-1;
(6)用CO还原金属氧化物,反应的平衡常数K均可表示为$[\frac{c(C{O}_{2})}{c(CO)}]^{n}$,n>0,因此lg$\frac{c(C{O}_{2})}{c(CO)}$越小,则平衡常数越大.对于CO还原Cr2O3和SnO2,温度升高lg$\frac{c(C{O}_{2})}{c(CO)}$减小,则平衡常数增大,平衡正向移动,因此这两个反应为吸热反应,对于CO还原PbO2和Cu2O的反应为放热反应;一氧化碳还原Cr2O3的反应为3CO(g)+Cr2O3(s)?2Cr(s)+3CO2(g),在700℃用一氧化碳还原Cr2O3时,lg$\frac{c(C{O}_{2})}{c(CO)}$=4,$\frac{c(C{O}_{2})}{c(CO)}$=10-4,K=(10-4)3=10-12;
故答案为:Cr2O3、SnO2;10-12.
点评 本题考查较为综合,涉及化学平衡影响因素的分析判断,反应速率的计算应用,为高频考点,侧重于学生的分析能力和计算能力的考查,平衡移动原理的应用是解题关键,依据反应特征设计制备过程是解题关键,题目难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 往蔗糖与稀硫酸共热后的溶液中滴加银氨溶液,再水浴加热,能看到银镜生成 | |
| C. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| D. | 向鸡蛋清溶液中加硫酸铵饱和溶液,有沉淀析出,再加水沉淀溶解 |
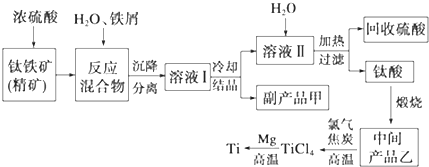
(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化成Fe3+,可循环利用的物质是硫酸,检验副产品甲是否变质的实验方法是取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质
(3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O=TiO(OH)2↓+2H+.
(4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是隔绝空气,反应后的产物需要加入稀盐酸(或稀硫酸)溶解后才能达到提纯金属钛的目的.
| ① | ② | ③ | ④ | |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | 若①②③④四种溶液等体积混合,混合液pH=7,则混合液中c(NH4+)=c(CH3COO-) | |
| B. | ①④两溶液等体积混合,混合液中c(H+)>c(OH-) | |
| C. | ①③溶液中水的电离程度相等 | |
| D. | V1L②和V2L④溶液混合后溶液pH=9,则V1=$\frac{11}{9}$V2 |
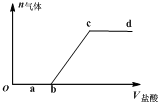 向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应溶液中:Ca2+、Mg2+、Br-、NO3- | |
| B. | b点对应溶液中:Al3+、Fe3+、MnO4-、NO3- | |
| C. | c点对应溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应溶液中:F-、NO3-、Fe2+、Ag+ |
| A. | 3种 | B. | 2种 | C. | 5种 | D. | 6种 |
| 选项 | 甲中试剂 | 乙中试剂 | 气体成份及实验目的 | 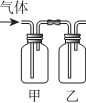 |
| A | NaHSO3溶液 | 硅酸钠溶液 | HCl:证明非金属Cl>S>Si | |
| B | FeI2淀粉溶液 | FeI2、KSCN溶液 | Cl2:验证氧化性Cl2>Fe3+>I2 | |
| C | 溴水 | AgNO3溶液 | 乙烯:验证溴水与乙烯发生的是加成反应 | |
| D | Ba(OH)2溶液 | 品红溶液 | 验证混合气体中含有SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |