题目内容
7.已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图1所示: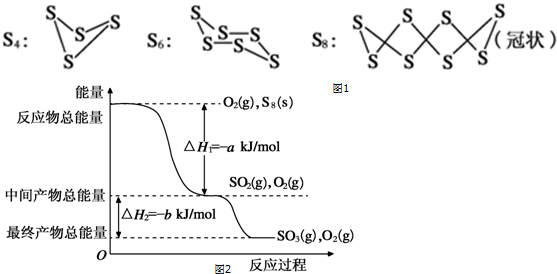
回答下列问题:
(1)下列有关说法正确的是CE
A.S2、S4、S6、S8互为同系物 B.S8转化为S6、S4、S2属于物理变化
C.不论哪种硫分子,完全燃烧时都生成SO2 D.常温条件下单质硫为原子晶体
E.32gS8单质含有的S-S键个数为NA
(2)在一定温度下,测得硫蒸气的平均摩尔质量为80g/mol,则该蒸气中S2分子的体积分数不小于75%.
(3)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用图2简单表示(图中的△H表示生成1mol产物的数据).
①写出表示S8燃烧的热化学方程式S8(s)+8O2(g)═8SO2(g)△H=-8akJ•mol-1
②写出SO3分解生成SO2和O2的热化学方程式SO3(g)=SO2(g)+$\frac{1}{2}$O2(g)△H=+bKJ/mol.
分析 (1)A.同种元素形成的不同单质是同素异形体;
B.同素异形体间的转化是化学变化;
C.硫元素组成的单质燃烧产物是二氧化硫;
D.单质硫为分子晶体;
E.一个S8分子(其“皇冠”结构如图)中含有的S-S键个数为8个;
(2)当S2、S4 时S2分子的体积分数最小;结合平均值方法计算体积分数;
(3)①S8(s)和O2(g)发生反应转化为SO2(g)时放热为燃烧热,标注物质聚集状态和反应焓变写出热化学方程式;
②分析图象能量变化,写出化学方程式,标注物质聚集状态和反应焓变写出热化学方程式.
解答 解:(1)A.同种元素形成的不同单质是同素异形体,故A错;
B.同素异形体间的转化是化学变化,故B错;
C.硫元素组成的单质燃烧产物是二氧化硫,故C正确;
D.常温下单质硫为分子晶体,故D错误;
E.一个S8分子(其“皇冠”结构如图)中含有的S-S键个数为8个,32gS8单质物质的量=$\frac{32g}{8×32g•mo{l}^{-1}}$=0.125mol,含有的S-S键个数为NA,故E正确;
故答案为:CE;
(2)当S2、S4时S2分子的体积分数最小,设S2物质的量为X,S4物质的量为Y,$\frac{64X+128Y}{X+Y}$=80;得到X:Y=3:1,相同条件下气体物质的量之比等于体积之比物得到,该蒸气中S2分子的体积分数不小于75%,
故答案为:75%;
(3)①S8(s)和O2(g)发生反应转化为SO2(g)时放热为燃烧热,由图可知生成1molSO2(g)放出热量为akJ,
则燃烧热的S8(s)+8O2(g)═8SO2(g)△H=-8akJ•mol-1,
故答案为:S8(s)+8O2(g)═8SO2(g)△H=-8akJ•mol-1;
②依据图象分析结合反应能量变化,写出化学方程式,标注物质聚集状态和反应热,
SO3分解生成SO2和O2的热化学方程式为:SO3(g)=SO2(g)+$\frac{1}{2}$O2(g)△H=+bKJ/mol,
故答案为:SO3(g)=SO2(g)+$\frac{1}{2}$O2(g)△H=+bKJ/mol.
点评 本题考查了反应能量变化的分析判断,焓变的计算应用,热化学方程式的书写,图象分析和概念理解是解题关键,题目难度中等.

(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180℃-200℃}^{50-80℃}$Ni(CO)4(g).利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是CD(填字母编号).
A.把温度由80℃升高到180℃,正反应速率减小,逆反应速率增大
B.反应达到平衡后,充入Ni(CO)4(g)再次达到平衡时,$\frac{n[Ni(CO)_{4}]}{{n}^{4}(CO)}$减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当容器中混合气体密度不变时,可说明反应已达化学平衡状态
(2)图1所示的直形石英玻璃封管中充有CO气体,在温度为T1的一端放置不纯的镍(Ni)粉,Ni粉中的杂质不与CO(g)发生反应.在温度为T2的一端得到了纯净的高纯镍,则温度T1<T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是CO.
(3)甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、 2mol H2 | 1mol CH3OH | 2mol CO、 4mol H2 |
| CH3OH的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 反应物转化率 | α1 | α2 | α3 |
a.c1=c2 b.2Q1=Q3 c.Q1+Q2=90.8 d.α2+α3<100%
(4)据研究,上述(3)中合成甲醇反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是Cu2O+CO?2Cu+CO2(用化学方程式表示).
(5)已知在常温常压下:甲醇的燃烧热为725.8kJ•mol-1,CO的燃烧热为283kJ•mol-1,H2O(g)═H2O(l)△H=-44.0kJ•mol-1.写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ•mol-1.

(6)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳.如图2是四种金属氧化物(Cr2O3、SnO-1、PbO2、Cu2O)被一氧化碳还原时lg$\frac{c(CO)}{c(C{O}_{2})}$与温度(t)的关系曲线图.四个反应中属于吸热反应的是Cr2O3、SnO2(填金属氧化物的化学式),在700℃用一氧化碳还原Cr2O3时,若反应方程式化学计量数为最简整数比,该反应的平衡常数(K)数值等于10-12.
| A. | O2-、Cl-、K+ | B. | Cl-、Na+、Al3+ | C. | Na+、Mg2+、F- | D. | O2-、Mg2+、Cl- |
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |
| A. | 钾和镁的次外层电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 等体积的CO和NO含有的原子数 | |
| D. | 等物质的量的钠分别在常温下和点燃条件下与氧气反应转移的电子数 |
| A. | 制铝:以铝土矿为原料获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 | |
| B. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融氧化镁得镁 | |
| C. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| D. | 制铁:以铁矿石为原料,利用焦炭与氧气反应生成的CO在高温下还原得铁 |
| A. | CO | B. | CH4 | C. | CH3CH3 | D. | CH2=CH2 |
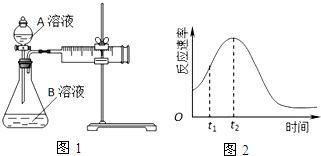
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
| ② | 20mL 0.2mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填实验序号).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol•L-1.(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.(一条即可)
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;
②产物Mn2+是反应的催化剂.