题目内容
5.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.“硫酸法”生产钛的原料是钛铁矿[主要成分是钛酸亚铁(FeTiO3),含有Fe(Ⅲ)等杂质],同时获得副产品甲的工业生产流程如下: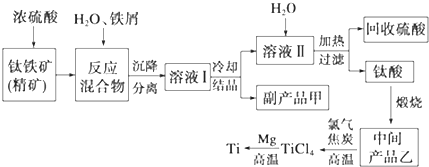
(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,写出该反应的化学方程式FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化成Fe3+,可循环利用的物质是硫酸,检验副产品甲是否变质的实验方法是取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质
(3)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O=TiO(OH)2↓+2H+.
(4)中间产品乙是一种氧化物,其经高温与氯气、焦炭反应,除生成TiCl4外,还生成了一种可燃性气体,请写出该反应的化学方程式TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还原控制的反应条件是隔绝空气,反应后的产物需要加入稀盐酸(或稀硫酸)溶解后才能达到提纯金属钛的目的.
分析 由流程可知,钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质)中加入浓硫酸,FeTiO3发生反应:FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O,钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,溶液Ⅰ中含有FeSO4和TiOSO4,溶液Ⅱ主要含有TiOSO4,加入水,加热可水解生成H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti,
(1)浓硫酸处理钛铁矿时产物之一是TiOSO4,反应中无气体放出,同时生成硫酸亚铁和水;
(2)铁能够与铁离子反应,加入铁粉可防止铁离子氧化;可循环利用的物质是硫酸;根据流程可知副产品甲为FeSO4•7H2O,已经亚铁离子的还原性易被氧化为铁离子,铁离子遇到KSCN溶液显示血红色设计实验检验是否变质;
(3)①依据氢氧化镁的溶度积常数进行计算即可;
②已知TiO2+发生水解生成钛酸(H2TiO3)沉淀,根据元素守恒写出反应的离子方程式;
(4)乙为TiO2,反应物为乙为TiO2、氯气、C,反应产物为四氯化钛和CO,反应条件为高温,据此写出反应的化学方程式;
(5)为防止碳与氧气反应,应可绝空气加热;反应后的产物需要加稀酸溶解后才能达到提纯金属钛的目的.
解答 解:钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质)中加入浓硫酸,FeTiO3发生反应:FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O,钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,溶液Ⅰ中含有FeSO4和TiOSO4,溶液Ⅱ主要含有TiOSO4,加入水,加热可水解生成H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti,
(1)加入浓硫酸,FeTiO3发生反应:FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O,
故答案为:FeTiO3+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$TiOSO4(硫酸氧钛)+FeSO4+2H2O;
(2)铁可与Fe3+反应生成Fe2+,加入铁屑,可防止Fe2+氧化,从流程图硫酸与过量的铁反应可知,副产品甲是FeSO4•7H2O,可循环利用的物质是硫酸,检验副产品甲是否变质的实验方法是取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质,
故答案为:防止Fe2+氧化成Fe3+;硫酸;取副产品溶于水,滴入KSCN溶液变血红色证明副产品甲变质,若溶液不产生血红色,则甲不变质;
(3)①Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.8×10-11,故c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{0.0018}}$=10-4,故c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10,故此时pH=10,故答案为:10;
②已知TiO2+发生水解生成钛酸(H2TiO3)沉淀和氢离子,其离子方程式为:TiO2++2H2O═H2TiO3↓+2H+,
故答案为:TiO2++2H2O═H2TiO3↓+2H+;
(4)中间产物乙为TiO2,TiO2与焦炭、氯气在高温下发生反应生成四氯化钛和一氧化碳,反应的方程式为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;
(5)为防止碳与氧气反应,应可绝空气加热,反应后的产物需要加入稀盐酸(或稀硫酸)镁溶解后才能达到提纯金属钛的目的,
故答案为:隔绝空气;稀盐酸(或稀硫酸).
点评 本题考查物质的制备实验方案的设计,题目难度中等,试题侧重于学生的分析能力和实验能力的考查,为高考常见题型,明确制备流程及反应原理为解答关键,注意把握实验的基本原理和常见物质的性质.

 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的氧化物对应的水化物一种是强酸 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
①用蒸馏的方法来分离甲苯、溴苯和辛烷的混合物
②石油分馏可得到汽油、煤油等,重整可得到芳香烃
③裂化汽油可使溴水褪色
④裂解的目的是获得乙烯、丙烯、丁二烯等气态烯烃
⑤聚乙烯可发生加成反应
⑥1-氯丙烷和
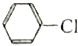 的水解反应均有醇生成.
的水解反应均有醇生成.| A. | 全都正确 | B. | 除⑤ | C. | 除⑥ | D. | ①②③④ |

| A. | 它的一氯代物有9种(不考虑立体异构) | |
| B. | 它的分子中最多有7个原子共平面 | |
| C. | 一定条件下,它分别可以发生加成、取代、氧化、还原反应 | |
| D. | 它和丁基苯(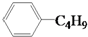 )互为同分异构体 )互为同分异构体 |
①2Fe2+(aq)+H2O2(l)+2H+(aq)═2Fe3+(aq)+2H2O(l)△H1
②2Fe3+(aq)+H2O2(l)═2Fe2+(aq)+O2(g)+2H+(aq)△H2
下列说法不正确的是( )
| A. | H2O2分解的热化学方程式为H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-98 kJ•mol-1 | |
| B. | 反应速率与Fe2+浓度有关 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | △H1+△H2=196 kJ•mol-1 |
(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180℃-200℃}^{50-80℃}$Ni(CO)4(g).利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是CD(填字母编号).
A.把温度由80℃升高到180℃,正反应速率减小,逆反应速率增大
B.反应达到平衡后,充入Ni(CO)4(g)再次达到平衡时,$\frac{n[Ni(CO)_{4}]}{{n}^{4}(CO)}$减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当容器中混合气体密度不变时,可说明反应已达化学平衡状态
(2)图1所示的直形石英玻璃封管中充有CO气体,在温度为T1的一端放置不纯的镍(Ni)粉,Ni粉中的杂质不与CO(g)发生反应.在温度为T2的一端得到了纯净的高纯镍,则温度T1<T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是CO.
(3)甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、 2mol H2 | 1mol CH3OH | 2mol CO、 4mol H2 |
| CH3OH的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 反应物转化率 | α1 | α2 | α3 |
a.c1=c2 b.2Q1=Q3 c.Q1+Q2=90.8 d.α2+α3<100%
(4)据研究,上述(3)中合成甲醇反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是Cu2O+CO?2Cu+CO2(用化学方程式表示).
(5)已知在常温常压下:甲醇的燃烧热为725.8kJ•mol-1,CO的燃烧热为283kJ•mol-1,H2O(g)═H2O(l)△H=-44.0kJ•mol-1.写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ•mol-1.

(6)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳.如图2是四种金属氧化物(Cr2O3、SnO-1、PbO2、Cu2O)被一氧化碳还原时lg$\frac{c(CO)}{c(C{O}_{2})}$与温度(t)的关系曲线图.四个反应中属于吸热反应的是Cr2O3、SnO2(填金属氧化物的化学式),在700℃用一氧化碳还原Cr2O3时,若反应方程式化学计量数为最简整数比,该反应的平衡常数(K)数值等于10-12.
| A. | 3.1g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1mol丙烯醛中含有双键的数目为0.1NA | |
| C. | 标准状况下,2.24L乙醇中含有的分子数目为0.1NA | |
| D. | 1molNaHSO4固体中阳离子的数目为2NA |
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |