题目内容
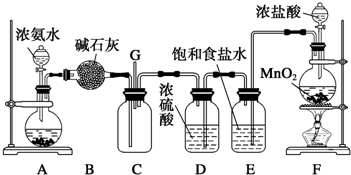
6.按表中所述内容进行实验,可以实现相应的实验目的是( )| 选项 | 甲中试剂 | 乙中试剂 | 气体成份及实验目的 | 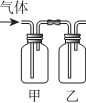 |
| A | NaHSO3溶液 | 硅酸钠溶液 | HCl:证明非金属Cl>S>Si | |
| B | FeI2淀粉溶液 | FeI2、KSCN溶液 | Cl2:验证氧化性Cl2>Fe3+>I2 | |
| C | 溴水 | AgNO3溶液 | 乙烯:验证溴水与乙烯发生的是加成反应 | |
| D | Ba(OH)2溶液 | 品红溶液 | 验证混合气体中含有SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
B.氯气能氧化亚铁离子生成铁离子,能氧化碘离子生成碘,碘遇淀粉试液变蓝色,铁离子与KSCN溶液混合生成血红色液体;
C.溴具有挥发性,无论甲中发生取代反应还是加成反应,乙中都存在HBr;
D.SO2和CO2都能和Ba(OH)2溶液反应生成白色沉淀,二氧化硫能使品红溶液褪色.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,HCl不是Cl元素的最高价氧化物的水化物,所以不能根据该实验判断Cl元素与S、Si的非金属性强弱,故A错误;
B.氯气能氧化亚铁离子生成铁离子,能氧化碘离子生成碘,碘遇淀粉试液变蓝色,铁离子与KSCN溶液混合生成血红色液体,根据甲、乙溶液颜色变化确定氧化性强弱,故B正确;
C.溴具有挥发性,无论甲中发生取代反应还是加成反应,乙中都存在HBr,乙中都能产生淡黄色沉淀,故C错误;
D.SO2和CO2都能和Ba(OH)2溶液反应生成白色沉淀,二氧化硫能使品红溶液褪色,所以不能该实验不能验证气体中是否含有二氧化碳,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质检验、反应类型判断、氧化性强弱比较、酸性强弱比较等知识点,明确实验原理及物质性质特点是解本题关键,注意D中二氧化碳、二氧化硫都能和氢氧化钡、氢氧化钙反应生成白色沉淀,为易错点.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
16.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的氧化物对应的水化物一种是强酸 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
17.碳的化合物与人类生产、生活密切相关.
(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180℃-200℃}^{50-80℃}$Ni(CO)4(g).利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是CD(填字母编号).
A.把温度由80℃升高到180℃,正反应速率减小,逆反应速率增大
B.反应达到平衡后,充入Ni(CO)4(g)再次达到平衡时,$\frac{n[Ni(CO)_{4}]}{{n}^{4}(CO)}$减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当容器中混合气体密度不变时,可说明反应已达化学平衡状态
(2)图1所示的直形石英玻璃封管中充有CO气体,在温度为T1的一端放置不纯的镍(Ni)粉,Ni粉中的杂质不与CO(g)发生反应.在温度为T2的一端得到了纯净的高纯镍,则温度T1<T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是CO.
(3)甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列说法正确的是ac.
a.c1=c2 b.2Q1=Q3 c.Q1+Q2=90.8 d.α2+α3<100%
(4)据研究,上述(3)中合成甲醇反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是Cu2O+CO?2Cu+CO2(用化学方程式表示).
(5)已知在常温常压下:甲醇的燃烧热为725.8kJ•mol-1,CO的燃烧热为283kJ•mol-1,H2O(g)═H2O(l)△H=-44.0kJ•mol-1.写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ•mol-1.

(6)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳.如图2是四种金属氧化物(Cr2O3、SnO-1、PbO2、Cu2O)被一氧化碳还原时lg$\frac{c(CO)}{c(C{O}_{2})}$与温度(t)的关系曲线图.四个反应中属于吸热反应的是Cr2O3、SnO2(填金属氧化物的化学式),在700℃用一氧化碳还原Cr2O3时,若反应方程式化学计量数为最简整数比,该反应的平衡常数(K)数值等于10-12.
(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180℃-200℃}^{50-80℃}$Ni(CO)4(g).利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是CD(填字母编号).
A.把温度由80℃升高到180℃,正反应速率减小,逆反应速率增大
B.反应达到平衡后,充入Ni(CO)4(g)再次达到平衡时,$\frac{n[Ni(CO)_{4}]}{{n}^{4}(CO)}$减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当容器中混合气体密度不变时,可说明反应已达化学平衡状态
(2)图1所示的直形石英玻璃封管中充有CO气体,在温度为T1的一端放置不纯的镍(Ni)粉,Ni粉中的杂质不与CO(g)发生反应.在温度为T2的一端得到了纯净的高纯镍,则温度T1<T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是CO.
(3)甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、 2mol H2 | 1mol CH3OH | 2mol CO、 4mol H2 |
| CH3OH的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 反应物转化率 | α1 | α2 | α3 |
a.c1=c2 b.2Q1=Q3 c.Q1+Q2=90.8 d.α2+α3<100%
(4)据研究,上述(3)中合成甲醇反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是Cu2O+CO?2Cu+CO2(用化学方程式表示).
(5)已知在常温常压下:甲醇的燃烧热为725.8kJ•mol-1,CO的燃烧热为283kJ•mol-1,H2O(g)═H2O(l)△H=-44.0kJ•mol-1.写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ•mol-1.

(6)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳.如图2是四种金属氧化物(Cr2O3、SnO-1、PbO2、Cu2O)被一氧化碳还原时lg$\frac{c(CO)}{c(C{O}_{2})}$与温度(t)的关系曲线图.四个反应中属于吸热反应的是Cr2O3、SnO2(填金属氧化物的化学式),在700℃用一氧化碳还原Cr2O3时,若反应方程式化学计量数为最简整数比,该反应的平衡常数(K)数值等于10-12.
14.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 3.1g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1mol丙烯醛中含有双键的数目为0.1NA | |
| C. | 标准状况下,2.24L乙醇中含有的分子数目为0.1NA | |
| D. | 1molNaHSO4固体中阳离子的数目为2NA |
11.锰是重要的过渡元素.
(1)已知常温下KMnO4溶液的pH=7,则0.01mol/LHMnO4溶液的pH=2;研究表明,一定温度下将酸性KMnO4溶液与草酸溶液混合在一起后,溶液内n(Mn2+)随时间变化的情况如图1,则Mn2+物质的量在t1、t2时段内快速增加的原因可能是反应生成的Mn2+对反应起催化作用.
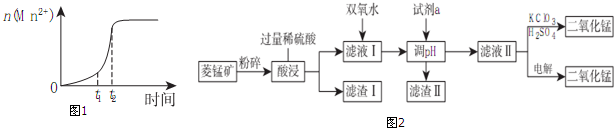
(2)工业上以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰有多种方法,图2是其中的一种生产流程示意图
常温下几种金属氢氧化物沉淀时的pH:
①滤渣Ⅱ的成分是Cu(OH)2、Fe(OH)3,滤液I中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
为确保除尽杂质而又不损失锰,pH的调整范围为6.7≤pH<8.3.
②滤液Ⅱ中加入KClO3、H2SO4后反应的化学方程式为3MnSO4+KClO3+3H2O=3H2SO4+3MnO2↓+KCl,用电解法制备MnO2时阳极上的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(3)锰也是制备某些高能原电池的材料,某二次水溶液锂离子电池充电时,总反应方程式为LiMn2O═4Li1-xMn2O4+xLi.若电池的化学能转化为电能时的能量转化率为85%,则当消耗14g锂时,电路中转移的电子数目为1.7 NA.
(1)已知常温下KMnO4溶液的pH=7,则0.01mol/LHMnO4溶液的pH=2;研究表明,一定温度下将酸性KMnO4溶液与草酸溶液混合在一起后,溶液内n(Mn2+)随时间变化的情况如图1,则Mn2+物质的量在t1、t2时段内快速增加的原因可能是反应生成的Mn2+对反应起催化作用.

(2)工业上以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰有多种方法,图2是其中的一种生产流程示意图
常温下几种金属氢氧化物沉淀时的pH:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 10.0 | 8.4 | 3.7 | 6.7 |
为确保除尽杂质而又不损失锰,pH的调整范围为6.7≤pH<8.3.
②滤液Ⅱ中加入KClO3、H2SO4后反应的化学方程式为3MnSO4+KClO3+3H2O=3H2SO4+3MnO2↓+KCl,用电解法制备MnO2时阳极上的电极反应式为Mn2++2H2O-2e-=MnO2+4H+.
(3)锰也是制备某些高能原电池的材料,某二次水溶液锂离子电池充电时,总反应方程式为LiMn2O═4Li1-xMn2O4+xLi.若电池的化学能转化为电能时的能量转化率为85%,则当消耗14g锂时,电路中转移的电子数目为1.7 NA.
18.下列微粒中,电子层结构完全相同的是( )
| A. | O2-、Cl-、K+ | B. | Cl-、Na+、Al3+ | C. | Na+、Mg2+、F- | D. | O2-、Mg2+、Cl- |
15.将三种黑色粉末组成的混和物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体.将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为( )
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |
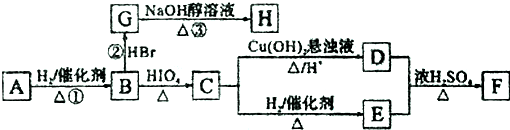
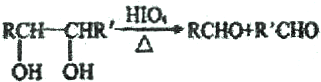 .
.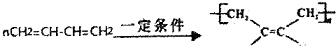 ,若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
,若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.