题目内容
6.下列说法正确的是( )| A. | 酯化反应也属于加成反应 | |
| B. | 酯化反应中酸脱去羟基,醇脱去氢原子 | |
| C. | 浓硫酸在酯化反应中只起催化剂的作用 | |
| D. | 乙酸乙酯的结构简式为CH3COOCH3 |
分析 A.酯化反应属于取代反应;
B.酯化反应中羧酸提供羟基,醇提供羟基上的H;
C.浓硫酸在酯化反应中既是催化剂也是吸水剂;
D.乙酸乙酯中含有4个碳原子,据此解答即可.
解答 解:A.酯化反应属于取代反应的一种,不是加成反应,故A错误;
B.酯化反应中羧酸脱去羟基,醇脱掉羟基上的H,故B正确;
C.浓硫酸在酯化反应中,是催化剂也是吸水剂,故C错误;
D.乙酸乙酯的结构简式为:CH3COOCH2CH3,故D错误,
故选B.
点评 本题主要考查的是取代反应的定义、酯化反应的原理以及乙酸乙酯的结构简式等,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
14.实验室中有一未知浓度的稀盐酸,某学生取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用浓度为0.1mol/L的标准NaOH溶液进行滴定.重复上述滴定操作2次,记录数据如下:
(1)滴定达到终点的现象是最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色.此时锥形瓶内溶液的pH为8.2~10.
(2)根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有DF.(多选扣分)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量前NaOH固体中混有Na2CO3固体
E.NaOH标准溶液部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失.
| 实验编号 | NaOH溶液体积(mL) | 待测盐酸的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
(2)根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有DF.(多选扣分)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量前NaOH固体中混有Na2CO3固体
E.NaOH标准溶液部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失.
1.烟气中含夺SCX夺大量有害的物质,烟气除硫的方法有多种,其中石灰石法烟气除硫工艺的主要反应如下:
I CaCO3 (s)?CO2 (g)+CaO(s)△H=+178kJ/mol
ⅡSO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ2CaS03(S)+02 (g)+4H2O(I)?2(CaS04•2H2O](S)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式2SO2(g)+2CaS03(s)+02(g)+4H2O(l)=2[CaS04•2H2O](s)△H=-681.8kJ/mol.
(2)反应Ⅱ为烟气除硫的关健,取相同用量的反应物在3种不网的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容絶热,且初始时3个容器的容积和温度均相同,下列说法正确的是ad.
a.3个容器中SO2的平衡转化率的大小顺序为 aA>aB>aC.
b.当A容器内气体的平均摩尔质量不变时,说明谈反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据上述反应Ⅱ来除硫,将一定量的烟气压缩到一个20L的容器中,测得不同温度下,容器内SO2的质量(mg)如下表:
①在T1温度下,计算20〜40min内SO2的反应速率2×10-5mol/(L•min)
②若其它条件都相同T1< T2,《填“>”、“<”或“=”下同);x>0.06.
③在T2温度下,若平衡后将容器的容器压缩为10L,则新平衡时SO2的浓度平衡时SO2的浓度=(填“>”、“C”或“=”)理由是该反应的平衡常数表达式为K=$\frac{1}{c(S{O}_{2})}$,温度不变,K不变,所以浓度相等.
I CaCO3 (s)?CO2 (g)+CaO(s)△H=+178kJ/mol
ⅡSO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ2CaS03(S)+02 (g)+4H2O(I)?2(CaS04•2H2O](S)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式2SO2(g)+2CaS03(s)+02(g)+4H2O(l)=2[CaS04•2H2O](s)△H=-681.8kJ/mol.
(2)反应Ⅱ为烟气除硫的关健,取相同用量的反应物在3种不网的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容絶热,且初始时3个容器的容积和温度均相同,下列说法正确的是ad.
a.3个容器中SO2的平衡转化率的大小顺序为 aA>aB>aC.
b.当A容器内气体的平均摩尔质量不变时,说明谈反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据上述反应Ⅱ来除硫,将一定量的烟气压缩到一个20L的容器中,测得不同温度下,容器内SO2的质量(mg)如下表:
| 时间/min SO3/mg 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
②若其它条件都相同T1< T2,《填“>”、“<”或“=”下同);x>0.06.
③在T2温度下,若平衡后将容器的容器压缩为10L,则新平衡时SO2的浓度平衡时SO2的浓度=(填“>”、“C”或“=”)理由是该反应的平衡常数表达式为K=$\frac{1}{c(S{O}_{2})}$,温度不变,K不变,所以浓度相等.
11.如图是部分短周期主族元素原子半径与原子序数的关系.下列说法正确的是( )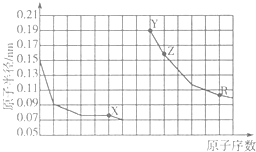

| A. | X、R的最简单氢化物的稳定性:X<R | |
| B. | X、Y、Z形成简单离子的半径大小:X>Y>Z | |
| C. | X、Y形成的化合物中只含有离子键 | |
| D. | Z单质着火可以用干冰进行灭火 |
18.水的电离常数如图两条曲线a与b所示,曲线中的点都符合c(H+)×c(OH-)=常数.下列说法正确的是( )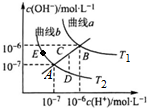

| A. | 图中温度T2>T1 | |
| B. | 曲线a、b均代表纯水的电离情况 | |
| C. | 图中五点的Kw的关系:B>C>A>D=E | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液呈碱性 |
13.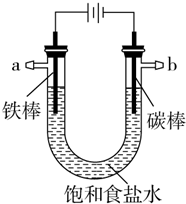 以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )
以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )
 以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )
以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )| A. | 阳极电极反应式:Fe-3e-═Fe3+ | |
| B. | 水被电解后析出白色浑浊物为NaCl晶体 | |
| C. | 灰绿色浑浊是Fe(OH)2 | |
| D. | 随着电解的进行,溶液逐渐由中性变成碱性 |
 完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为 mol/L D.
mol/L D. mol/L
mol/L

 、
、 (写结构简式).
(写结构简式). .
. (写结构简式).
(写结构简式).