题目内容
13.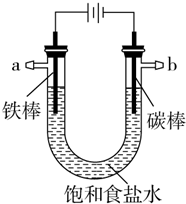 以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )
以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )| A. | 阳极电极反应式:Fe-3e-═Fe3+ | |
| B. | 水被电解后析出白色浑浊物为NaCl晶体 | |
| C. | 灰绿色浑浊是Fe(OH)2 | |
| D. | 随着电解的进行,溶液逐渐由中性变成碱性 |
分析 A.阳极上Fe失电子生成亚铁离子;
B.阴极水被电解生成氢氧根离子,氢氧根离子与亚铁离子结合生成氢氧化亚铁;
C.氢氧化亚铁部分被氧化生成氢氧化铁;
D.氯化钠溶液显中性,阴极水被电解生成氢氧根离子,溶液显碱性.
解答 解:A.阳极上Fe失电子生成亚铁离子,则阳极的电极方程式为:Fe-2e-═Fe2+,故A错误;
B.阴极水被电解生成氢氧根离子,氢氧根离子与亚铁离子结合生成氢氧化亚铁,所以水被电解后析出白色浑浊物为氢氧化亚铁沉淀,故B错误;
C.电解生成的氢氧化亚铁沉淀不稳定,能被氧气氧化生成氢氧化铁,所以灰绿色浑浊是Fe(OH)2和Fe(OH)3的混合物,故C错误;
D.氯化钠溶液显中性,电解时,阴极上水被电解生成氢气和氢氧根离子,所以溶液显碱性,故D正确.
故选D.
点评 本题考查了电解池原理、铁的化合物的性质,题目难度不大,注意Fe在阳极失电子生成的是亚铁离子,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 酯化反应也属于加成反应 | |
| B. | 酯化反应中酸脱去羟基,醇脱去氢原子 | |
| C. | 浓硫酸在酯化反应中只起催化剂的作用 | |
| D. | 乙酸乙酯的结构简式为CH3COOCH3 |
1.某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出).
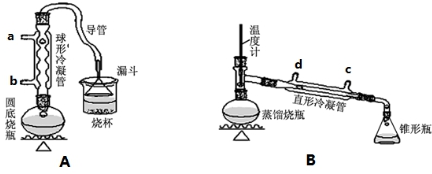
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是既可以吸收充分,又可以防止倒吸.两个装置中都用到了冷凝管,A装置中冷水从b(填字母代号)进入,B装置中冷水从c(填字母代号)进入.
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是ab.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3).请评价该同学设计的鉴定方案是否合理?为什么?答:不合理,产物1-溴丁烷也含有-CH2CH2CH2CH3.
(4)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
则用B装置完成此提纯实验时,实验中要迅速升高温度至101.6℃收集所得馏分.

请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是既可以吸收充分,又可以防止倒吸.两个装置中都用到了冷凝管,A装置中冷水从b(填字母代号)进入,B装置中冷水从c(填字母代号)进入.
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是ab.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3).请评价该同学设计的鉴定方案是否合理?为什么?答:不合理,产物1-溴丁烷也含有-CH2CH2CH2CH3.
(4)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
18.如表实验中,对应的现象和结论都正确,且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将少量碳酸钙粉末加入到饱和NH4Cl溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
| B | 将BaSO4固体粉末加入饱和Na2CO3溶液中,搅拌,过滤,洗涤,在滤渣中加入稀盐酸 | 产生气体,滤渣部分溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 将黑色氧化铜粉末进行高温加热 | 黑色变成红色 | CuO分解生成铜单质 |
| D | 将某溶液滴加过量的稀盐酸 | 有刺激性气味气体产生,溶液中出现沉淀 | 溶液中一定存在S2-和SO32- |
| A. | A | B. | B | C. | C | D. | D |
2.天然化合物M(假蜜环菌素)的结构简式如图所示.对M的结构与性质叙述错误的是( )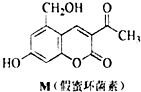

| A. | M的分子式为C12H10O5 | |
| B. | M与Br2只能发生取代反应,不能发生加成反应 | |
| C. | 1 mol M最多能与3mol NaOH反应 | |
| D. | M既能与FeCl3溶液发生反应,也能与CH3COOH发生反应 |
 有M、X、Y、Z、Q五种元素.M元素的电负性在所有元素中最大,X原子最外层电子数比内层电子总数多1;Y原子s轨道和p轨道电子数相同,且有2个单电子;Z原子核外有3种能级,每种能级所含电子数相同;Q的原子序数为M、Y、Z原子序数之和.
有M、X、Y、Z、Q五种元素.M元素的电负性在所有元素中最大,X原子最外层电子数比内层电子总数多1;Y原子s轨道和p轨道电子数相同,且有2个单电子;Z原子核外有3种能级,每种能级所含电子数相同;Q的原子序数为M、Y、Z原子序数之和. .
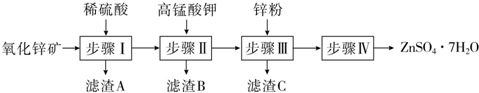
.
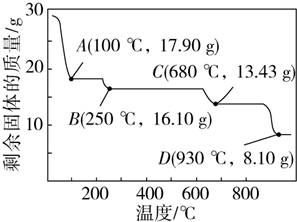
 .
.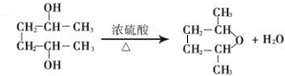 .
.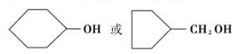 .
.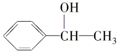 .
.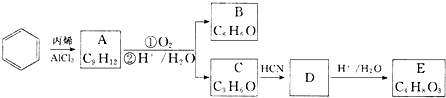
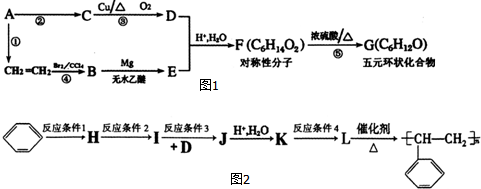
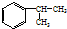 ,A的含有苯环的同分异构体(除A外)有7种.
,A的含有苯环的同分异构体(除A外)有7种.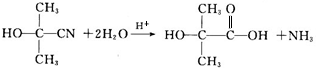 .
.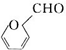 )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式:
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式: .
. ,G
,G .
.