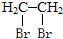题目内容
3.下列有关金属的工业制法中,不正确的是( )| A. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| B. | 制镁:用海水为原料,经一系列过程制得氯化镁固体,电解熔融的氯化镁得镁 | |
| C. | 制铁:以铁矿石为原料,CO还原得铁 | |
| D. | 制铝:从铝土矿中获得氧化铝,提纯后电解熔融的氧化铝得到铝 |
分析 根据金属的活泼性不同采用不同的方法,金属的冶炼一般有电解法、热还原法、热分解法、物理分离法.电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得,据此解答.
解答 解:A.钠性质活泼,用电解熔融的氯化钠方法制取,电解氯化钠溶液不能得到金属钠,故A错误;
B.镁性质活泼,用电解熔融的氯化镁的方法制取,故B正确;
C.铁性质较不活泼,用热还原反应制取,故C正确;
D.氯化铝为共价化合物,熔融状态不能电离,铝性质活泼,工业上用电解氧化铝的方法制取,故D正确;
故选A.
点评 本题主要考查了金属的冶炼,熟悉金属的活泼性和冶炼方法是解题关键,题目难度不大.

练习册系列答案
相关题目
11.下列各有机物中,属于烃的是( )
| A. | 氯丁烷 | B. | 苯的同系物 | C. | 硝基苯 | D. | 乙醇 |
18.下表是元素周期表的一部分,回答下列问题:
(1)上表中,可用来制作半导体材料的物质的组成元素是Si(填元素符号).
(2)S元素的最高正化合价是+6.
(3)Na、Mg、Al三种元素的金属性逐渐减弱(填“减弱”或“增强”).
(4)某元素位于元素周期表中第3周期第ⅦA族,该元素的原子结构示意图是c(选填编号).
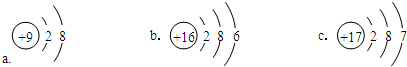
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | O | ||||||
| 3 | Na | Mg | Al | Si | S | |||
(2)S元素的最高正化合价是+6.
(3)Na、Mg、Al三种元素的金属性逐渐减弱(填“减弱”或“增强”).
(4)某元素位于元素周期表中第3周期第ⅦA族,该元素的原子结构示意图是c(选填编号).
8.下列叙述中,不正确的是( )
| A. | 钢铁在干燥的环境中不易腐蚀 | |
| B. | 原电池工作时,电解质溶液中的阳离子移向正极 | |
| C. | 用铝质铆钉铆接铁板,铆接处的铁板更易被腐蚀 | |
| D. | 集中回收处理废旧电池的主要目的是防止电池中的重金属离子污染土壤和水源 |
15.短周期主族元素X、Y、Z、W原子序数依次增大,X最外层电子数是次外层2倍,Y是非金属性最强的元素,Z原子半径在同周期元素中最大,W可与Z形成离子化合物Z2W.下列说法正确的是( )
| A. | 四种元素在自然界均不能以游离态存在 | |
| B. | X、Z、W均可形成两种常见氧化物 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
12.下列有关元素周期表的说法错误的是( )
| A. | 可在金属与非金属交界处寻找半导体材料 | |
| B. | 农药中常含有的元素通常在元素周期表的右上方区域内 | |
| C. | 作催化剂材料的元素通常在元素周期表的左下方区域内 | |
| D. | 在过渡元素中可寻找耐高温和耐腐蚀的合金材料 |

 、C
、C .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. B.
B.
 D.
D.
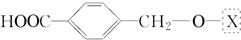 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.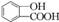 .
. 任意2种.
任意2种.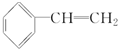 为主要原料制备
为主要原料制备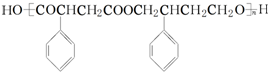 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).