题目内容
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M,关于该反应的说法中正确的有几项( )
①氧化剂是H3AsO3;
②还原性:Cl->As;
③每生成7.5g As,还原剂失去的电子为0.3mol;
④M为OH-;
⑤SnCl62-是氧化产物.
①氧化剂是H3AsO3;
②还原性:Cl->As;
③每生成7.5g As,还原剂失去的电子为0.3mol;
④M为OH-;
⑤SnCl62-是氧化产物.
| A、两项 | B、三项 | C、四项 | D、五项 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M,由原子守恒可知,M为H2O,Sn元素的化合价升高,As元素的化合价降低,结合氧化还原反应中还原剂的还原性大于还原产物的还原性及氧化剂的氧化性大于氧化产物的氧化性来解答.
解答:
解:①As元素的化合价降低,氧化剂为H3AsO3,故正确;
②Cl元素的化合价在该反应中不变,则不能比较Cl-、As的还原性,故错误;
③As元素由+3价降低为0,则每生成7.5g As,还原剂失去的电子为
×(3-0)=0.3mol,故正确;
④由原子守恒可知,M为H2O,故错误;
⑤因Sn元素的化合价升高,则SnCl62-为氧化产物,故正确.
故选B.
②Cl元素的化合价在该反应中不变,则不能比较Cl-、As的还原性,故错误;
③As元素由+3价降低为0,则每生成7.5g As,还原剂失去的电子为
| 7.5g |
| 75g/mol |
④由原子守恒可知,M为H2O,故错误;
⑤因Sn元素的化合价升高,则SnCl62-为氧化产物,故正确.
故选B.
点评:本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,注意原子守恒及氧化还原反应中氧化性比较规律,题目难度不大.

练习册系列答案
相关题目
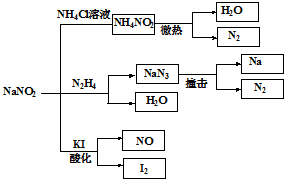 亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )
亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )| A、NH4NO2的热稳定性大于NaNO2 |
| B、NaN3分解,每产生1molN2转移6mole- |
| C、NaN3可用氨基钠(NaNH2)和N2O在液氨中低温制备,N2O与N3-互为等电子体 |
| D、可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
下列分离、提纯、鉴别物质的方法正确的是( )
| A、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| B、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| C、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
| D、用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
下列推论正确的是( )
| A、H2(g)的燃烧热是285.8 kJ?mol-1,则H2O(g)=2H2(g)+O2(g)△H=+285.8 kJ?mol-1 |
| B、对于反应2H2O2═2H2O+O2↑,升高温度能加快O2的生成速率 |
| C、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| D、在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-?[CuCl4]2-(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色 |
下列物质互为同分异构体的一组是( )
| A、35Cl和37Cl |
| B、CH3CH2OH和CH3OCH3 |
| C、O2和O3 |
| D、甲苯和邻二甲苯 |
区分晶体和非晶体的最可靠的科学方法是( )
| A、测定熔沸点的高低 |
| B、对固体进行X射线衍射 |
| C、看是否有规则的几何外形 |
| D、比较硬度 |
aXm+、bYn+、cZm-、dQn-(m>n)的电子层结构相同,下列说法正确的是( )
| A、原子半径的大小顺序为:X>Y>Z>Q |
| B、离子半径的大小顺序为:Xm+>Yn+>Zm->Qn- |
| C、m+a=d-n |
| D、b-n=c+m |
 某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )
某学生利用C、N、0三种原子拼接成了一种新型分子TetranitiBtoxycarbon(结构如图所示),科学家经过研究发现,这种分子具有良好的贮能特性,一旦被合成完全可用于制造新的炸药.下列有关说法正确的是( )| A、该分子的分子式为CNO3 |
| B、分子中既含极性键又含非极性键 |
| C、C、N的化合价分别为+4、+3 |
| D、C、N、0的第一电离能依次增大 |



