题目内容
3.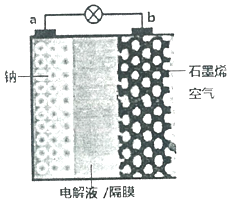 继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )| A. | a电极为负极 | |
| B. | Na+向b极移动 | |
| C. | a极发生氧化反应 | |
| D. | b电极的电极反应式:O2+2Na++4e-═Na2O2 |
分析 由反应2Na+O2=Na2O2可知,反应中Na元素化合价升高,被氧化,O元素化合价降低,被还原,则Na为负极,石墨烯、空气为正极,以此解答该题.
解答 解:A.钠被氧化,为负极反应,则a电极为负极,故A正确;
B.b为正极,原电池工作时,阳离子向正极移动,故B正确;
C.a为正极,发生氧化反应,故C正确;
D.b发生还原反应,电极方程式为O2+2Na++2e-═Na2O2,故D错误.
故选D.
点评 本题考查了原电池和电解池原理,为高频考点,侧重考查学生的分析能力,明确正负极上得失电子及电极反应是解本题关键,难点是电极反应式的书写,难度中等.

练习册系列答案
相关题目
1.25℃时,1mol/L醋酸加水稀释至0.01mol/L,下列说法正确的是( )
| A. | 溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | B. | pH增大2个单位 | ||
| C. | 溶液中c(OH-)减小 | D. | Kw减小 |
14.化学与生产、生活与环境密切相关.下列说法错误的是( )
| A. | 为了防止白色污染应回收废旧塑料并加以焚烧 | |
| B. | 手机壳上贴的碳纤维膜是一种新型无机非金属材料 | |
| C. | 当今雾霾天气频发是由于人类活动对自然环境的影响所造成的 | |
| D. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 |
11.下列指定反应的离子方程式正确的是( )
| A. | Cl2通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| C. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| D. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
18.短周期主族元素W、X、Y、Z的原子序数依次增大,四种原子的最外层电子数之和为19.X原子的电子总数与最外层电子数之比为l:3,Y原子的最外层电子数与其内层电子总数之比为1:10.下列说法正确的是( )
| A. | 简单离子的半径:Y>X | |
| B. | 最简单气态氢化物的稳定性:W>X | |
| C. | 化合物WX、YZ中化学键类型相同 | |
| D. | W、Z的最高价氧化物对应的水化物均为强酸 |
8.向盛有10mLlmol/LNH4Al(SO4)2溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图.下列有关说法正确的是( )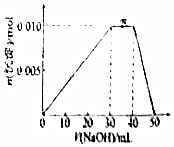

| A. | 当加入50mLNaOH时,溶液中的溶质为NaAlO2 | |
| B. | m点反应的离子方程式:NH4++OH-═NH3•H2O | |
| C. | NH4Al(SO4)2溶液中离子浓度由大到小的顺序是:c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 若向NH4Al(SO4)2溶液改加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.02mol |
15.下列有关说法不正确的是( )
| A. | 反应SiO2(s)+3C(s)═SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H>0 | |
| B. | 等pH的CH3COOH、HCl溶液混合后,平衡不移动,但c(CH3COO-)减少 | |
| C. | 配制KF溶液时,必需要加入KOH溶液抑制F-水解 | |
| D. | 向NaHS溶液中滴入少量CuCl2溶液产生黑色沉淀,HS-电离程度增大,pH减小 |
12.下列能源不属于一次能源的是( )
| A. | 风力 | B. | 石油 | C. | 流水 | D. | 电力 |
13.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 热稳定性:Na2CO3>NaHCO3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 非金属性:Cl>Br |