题目内容
13.下列有关性质的比较,不能用元素周期律解释的是( )| A. | 酸性:H2SO4>H3PO4 | B. | 热稳定性:Na2CO3>NaHCO3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 非金属性:Cl>Br |
分析 A.非金属性越强,对应最高价含氧酸的酸性越强;
B.碳酸氢钠加热分解生成碳酸钠;
C.金属性越强,对应碱的碱性越强;
D.同主族从上到下非金属性减弱.
解答 解:A.非金属性S>P,对应最高价含氧酸的酸性为H2SO4>H3PO4,故A不选;
B.碳酸氢钠加热分解生成碳酸钠,则热稳定性:Na2CO3>NaHCO3,与元素周期律无关,故B选;
C.金属性Na>Mg,对应碱的碱性为NaOH>Mg(OH)2,故C不选;
D.同主族从上到下非金属性减弱,则非金属性:Cl>Br,故D不选;
故选B.
点评 本题考查元素周期律和周期表,为高频考点,把握元素在周期表的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
3.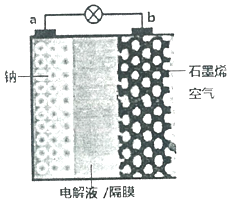 继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
 继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )| A. | a电极为负极 | |
| B. | Na+向b极移动 | |
| C. | a极发生氧化反应 | |
| D. | b电极的电极反应式:O2+2Na++4e-═Na2O2 |
4.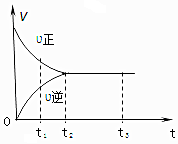 如图是可逆反应:X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应:X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
 如图是可逆反应:X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应:X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,反应只向正方向进行 | B. | t2时,反应未达到限度 | ||
| C. | t2~t3,反应已停止进行 | D. | t2~t3,各物质的浓度不再发生变化 |
1.下列的排序错误的是( )
| A. | 非金属性大小:Cl>S>P>Si | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:石英>食盐>干冰>钠 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
18.实验室用30%左右的H2SO4溶液(约3.7mol/L)与锌粒反应制取氢气.下列措施能加快反应速率的是( )
| A. | 适当降低温度 | B. | 将锌粒改为铜粉 | ||
| C. | 将所用硫酸改为98.3%浓硫酸 | D. | 滴加少量CuSO4溶液 |
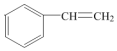
5.催化加氢可生成3-甲基戊烷的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列关于常温下各0.1mol的NaHCO3和Na2CO3的叙述中正确的是( )
| A. | 二者分别与少量邻羟基苯甲酸作用,所得产物相同 | |
| B. | 若将二者均配成0.1mol/L的溶液,前者的pH较大 | |
| C. | 分别加入过量盐酸充分反应后,二者产生CO2的体积在标准状况下均为2.24L | |
| D. | 若将二者分别加入1mL水中充分搅拌,恢复至室温后,只有后者有固体剩余 |
18.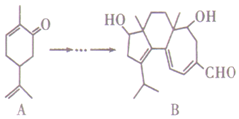 如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )
如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )
 如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )
如图,有机物B对治疗神经系统疾病有着很好的疗效,可用有机物A经过多步反应合成.下列说法不正确的是( )| A. | A的化学式为C10H14O | |
| B. | 与A互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 | |
| C. | A和B均能使酸性KMnO4溶液褪色 | |
| D. | B可以发生加成反应、消去反应和氧化反应 |
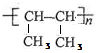 .
.
 .
.