题目内容
11.下列指定反应的离子方程式正确的是( )| A. | Cl2通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| C. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| D. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
分析 A.反应生成的HClO在离子反应中保留化学式;
B.电子不守恒;
C.酸性条件下不能生成OH-;
D.至SO42-恰好沉淀完全,与氢氧化钡以1:2反应生成硫酸钡、偏铝酸钾、水.
解答 解:A.Cl2通入水中的离子反应为Cl2+H2O?H++Cl-+HClO,故A错误;
B.用稀硝酸洗涤试管内壁的银镜的离子反应为3Ag+4H++NO3-═3Ag++NO↑+2H2O,故B错误;
C.用KIO3氧化酸性溶液中的KI的离子反应为5I-+IO3-+6H+═3I2+3H2O,故C错误;
D.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
9.X、Y、Z、W是处于相邻短周期的不同主族元素.已知:四种元素的最外层电子数之和为13;X的单质常温下能与水剧烈反应;W的单质是黑火药的主要成分之一,它的一种氧化物有毒,易溶于水;Z的原子半径小于W;Z的最外层电子数是Y最外层电子数的2倍.下列说法正确的是( )
| A. | 含氧酸的酸性、氢化物的沸点:W>Z | |
| B. | 原子半径:X>Y>W | |
| C. | X的氢化物、X2W溶于水后所得溶液都呈碱性 | |
| D. | Z的最高价氧化物常用作光导纤维 |
6.下列有关化学用语表示正确的是( )
| A. | 乙烯的实验式:H2C═CH2 | B. | 四氯化碳的电子式: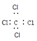 | ||
| C. | 含10个中子的氧原子:${\;}_{8}^{18}$O | D. | Al3+的结构示意图: |
16.短周期元素X、Y、Z、W的原子序数依次增大;X与Y、W可分别形成10e-、18e-的化合物甲和化合物乙,甲为非电解质,乙为强电解质,甲与乙常温下可化合得到离子化合物丙.X、Y、Z的最外层电子数之和等于W的最外层电子数.则下列说法正确的是( )
| A. | 化合物甲比乙的沸点低 | |
| B. | X、Y、Z、W的简单离子半径大小为:W>Y>Z>X | |
| C. | 丙属于正盐,其水溶液呈中性 | |
| D. | X和Z形成的二元化合物与乙的化学键类型相同 |
3.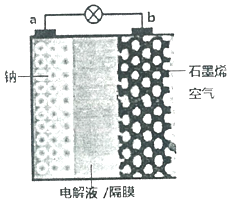 继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
 继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )| A. | a电极为负极 | |
| B. | Na+向b极移动 | |
| C. | a极发生氧化反应 | |
| D. | b电极的电极反应式:O2+2Na++4e-═Na2O2 |
20.关于有机物 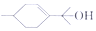 的说法不正确的是( )
的说法不正确的是( )
 的说法不正确的是( )
的说法不正确的是( )| A. | 有机物的分子式是C10H18O | B. | 能与溴水、钠发生反应 | ||
| C. | 能发生氧化、取代反应 | D. | 与HC1发生加成的产物只有1种 |
1.下列的排序错误的是( )
| A. | 非金属性大小:Cl>S>P>Si | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:石英>食盐>干冰>钠 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
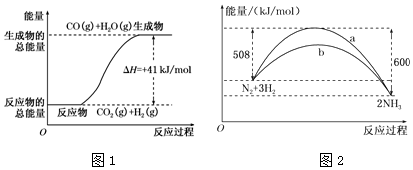
 ,它是一种非极性分子.(填“极性”或“非极性”)
,它是一种非极性分子.(填“极性”或“非极性”)