题目内容
4.某溶液中只可能含有下列离子中的某几种:Na+、NH4+、Ba2+、SO42-、Br-、AlO2-.分别取样:①用pH计测试,溶液显弱酸性 ②加氯水和CCl4振荡后静置,下层呈无色,为确定该溶液的组成,还需检验的离子是( )| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
分析 ①用pH计测试,溶液显弱酸性,可知不含AlO2-,一定含NH4+,
②加氯水和CCl4振荡后静置,下层呈无色,则一定不含Br-,结合溶液为电中性可知,一定含阴离子为SO42-,则不能存在Ba2+,以此来解答.
解答 解:由上述分析可知,一定含NH4+、SO42-,一定不含Ba2+、Br-、AlO2-,不能确定是否含Na+,则为确定该溶液的组成,还需检验的离子是Na+,
故选A.
点评 本题考查常见离子的检验,为高频考点,把握离子之间的反应、现象为解答的关键,侧重分析与应用能力的考查,注意电荷守恒及离子共存的应用,题目难度不大.

练习册系列答案
相关题目
14.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 在100 g质量分数为30%的甲醛水溶液中,含有氢原子数为2NA | |
| B. | 7.8 g Na2S和Na2O2固体混合物中,含有的阴离子数为0.1NA | |
| C. | 1mol乙醇含有共价键的总数7NA | |
| D. | 反应2SO2(g)+O2(g)?2 SO3 (g),单位时间内消耗NA个O2分子的同时生成2NA个SO3分子,此时反应达到平衡状态 |
15.下列操作或装置能达到实验目的是( )
| A. | 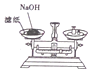 称取一定量的NaOH | |
| B. | 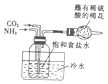 制取NaHCO3 | |
| C. | 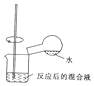 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 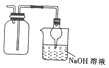 收集NO2丙防止其污染环境 |
12.下列离子方程式的书写正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 铁和稀硫酸反应:Fe+2H+═H2↑+Fe3+ | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O |
19.化学知识在生产和生活中有重要的应用,下列说法中不正确的是( )
| A. | 发酵粉中含有NaHCO3,能使焙制出的糕点疏松多孔 | |
| B. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 | |
| C. | 鼓励利用太阳能,风能等清洁能源,可以减少PM2.5的污染 | |
| D. | 金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 |
9.某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用.下列有关叙述中不正确的是( )

| A. | X能使酸性高锰酸钾溶液褪色 | |
| B. | Y的分子式为C9H8O3 | |
| C. | 1mol Z与足量NaOH溶液反应,最多消耗8mol NaOH | |
| D. | Z与浓溴水既能发生取代反应又能发生加成反应 |
7.下列离子方程式中不正确的是( )
| A. | 氢氧化钡溶液和硫酸钠溶液混合:Ba2++SO42-=BaSO4↓ | |
| B. | 将亚硫酸氢钠加入盐酸溶液中:HSO3-+H+=SO2↑+H2O | |
| C. | 氢硫酸与亚硫酸混合:H2SO3+2H2S=3S↓+3H2O | |
| D. | H2S气体通入CuSO4溶液中:Cu2++S2-=CuS↓ |
4.下列物质均有漂白作用,但其中一种的漂白原理与其它三种不同的是( )
| A. | HClO | B. | SO2 | C. | O3 | D. | H2O2 |
5.有未知浓度的Ba(OH)2和NaOH混合溶液,量取四份该溶液分别通入等量的CO2(已折算成标准状况下的体积,不考虑CO2在水中的溶解),生成沉淀的物质的量如表:
(1)该混合溶液中Ba(OH)2的物质的量浓度=1.50mol/L.
(2)实验Ⅲ最后所得溶液中碳酸钠的物质的量=0.0450mol.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| CO2体积(mL) | 2352 | 2352 | 2352 | 2352 |
| 样品体积(mL) | 20.0 | 30.0 | 40.0 | 50.0 |
| 沉淀物质的量(×10-2mol) | 1.50 | 4.50 | 6.00 | 7.50 |
(2)实验Ⅲ最后所得溶液中碳酸钠的物质的量=0.0450mol.