题目内容
5.有未知浓度的Ba(OH)2和NaOH混合溶液,量取四份该溶液分别通入等量的CO2(已折算成标准状况下的体积,不考虑CO2在水中的溶解),生成沉淀的物质的量如表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| CO2体积(mL) | 2352 | 2352 | 2352 | 2352 |
| 样品体积(mL) | 20.0 | 30.0 | 40.0 | 50.0 |
| 沉淀物质的量(×10-2mol) | 1.50 | 4.50 | 6.00 | 7.50 |
(2)实验Ⅲ最后所得溶液中碳酸钠的物质的量=0.0450mol.
分析 (1)Ba(OH)2和NaOH混合溶液的体积从30.0mL增大到40.0mL,从40.0mL增大到50.0mL,沉淀的物质的量都增大1.50×10-2mol,即混合溶液的体积为10mL,生成沉淀为1.50×10-2mol,所以10mL混合液中含有Ba(OH)2为1.50×10-2mol,然后计算Ba(OH)2的物质的量浓度;
(2)实验Ⅲ最后所得溶液中溶质为碳酸钡和碳酸钠,碳酸钡为0.06mol,根据碳元素守恒计算.
解答 解:(1)Ba(OH)2和NaOH混合溶液的体积从30.0mL增大到40.0mL,从40.0mL增大到50.0mL,沉淀的物质的量都增大1.50×10-2mol,即混合溶液的体积为10mL,生成沉淀为1.50×10-2mol,所以10mL混合液中含有Ba(OH)2为1.50×10-2mol,所以Ba(OH)2的物质的量浓度为:$\frac{1.50×1{0}^{-2}mol}{0.01L}$=1.50mol/L;
故答案为:1.50mol/L;
(2)实验Ⅲ最后所得溶液中溶质为碳酸钡和碳酸钠,碳酸钡为0.06mol,已知二氧化碳的体积为2352mL,则n(CO2)=$\frac{V}{{V}_{m}}$=$\frac{2.352L}{22.4L/mol}$=0.105mol,由碳元素守恒可知,碳酸钠的物质的量=0.105mol-0.06mol=0.0450mol;
故答案为:0.0450mol.
点评 本题考查了物质的量的有关计算,题目难度中等,注意把握物质的量和物质的量浓度的有关公式,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
4.某溶液中只可能含有下列离子中的某几种:Na+、NH4+、Ba2+、SO42-、Br-、AlO2-.分别取样:①用pH计测试,溶液显弱酸性 ②加氯水和CCl4振荡后静置,下层呈无色,为确定该溶液的组成,还需检验的离子是( )
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
16.分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A. | K2CO3和K2O都属于钾盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Na2CO3都属于碱 | D. | Na2O和Na2CO3都属于氧化物 |
13.下列过程与加成反应有关的是( )
| A. | 苯与溴水混合振荡,水层颜色变浅 | |
| B. | 乙烯与溴水混合振荡,水层颜色变浅 | |
| C. | 乙烯与高锰酸钾溶液混合振荡,溶液颜色变浅 | |
| D. | 甲烷与氯气混合光照,气体颜色变浅 |
20.下列叙述正确的是( )
| A. | 原电池将电能转化为化学能 | B. | 电解池将化学能转化为电能 | ||
| C. | 原电池的负极失电子 | D. | 电解池的阳极发生还原反应 |
10.在蒸发皿中蒸干下列物质的溶液,不能得到该物质固体的是( )
| A. | MgCl2 | B. | Fe2(SO4)3 | C. | K2CO3 | D. | NaCl |
17.已知:将Cl2通入适量浓NaOH溶液恰好完全反应,产物中可能有NaCl、NaClO、NaClO3、且$\frac{{c(C{l^-})}}{{c(Cl{O^-})}}$的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是( )
| A. | 参加反应的氯气的物质的量为6a mol | |
| B. | 改变温度,产物中NaCl的最小理论产量为4a mol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol | |
| D. | 某温度下,若反应后$\frac{{c(C{l^-})}}{{c(Cl{O^-})}}$=6,则溶液中$\frac{{c(C{l^-})}}{c(ClO_3^-)}=\frac{1}{2}$ |
14.下列关于有机化合物说法正确的是( )
| A. | 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯 | |
| B. | 淀粉与纤维素互为同分异构体,二者水解的最终产物相同 | |
| C. | 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程 | |
| D. | 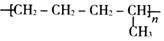 是由单体CH2=CH-CH3和CH2=CH2发生加聚反应的产物 是由单体CH2=CH-CH3和CH2=CH2发生加聚反应的产物 |
10.下列与胶体无关的是( )
| A. | 丁达尔效应 | B. | 明矾的净水作用 | ||
| C. | CuSO4溶液显蓝色 | D. | 分散质粒子直径1~100nm |