题目内容
(1)氮元素的氢化物和氧化物在工业生产和国防部建设中都有广泛应用,回答下列问题:
①氮元素原子的L层电子数为 ;
②NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
③肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:N2(g)+2O2(g)═N2O4(l)△H1=-19.5kJ?mol-1
N2H4(l)+O2 (g)═N2(g)+2H2O(g)△H2=-534.2kJ?mol-1
写出肼和N2O4反应的热化学方程式 ;该反应中氧化剂是 .
④写出肼一空气碱性燃料电池放电时正极的反应式为 ;若电池工作时负极产生无污染的N2,则当电池中转移4mol电子时,负极产生N2(按标态计) L.(不考虑各种损耗).
(2)KI溶液与Pb(NO3)2溶液混合可形成PbI2沉淀,已知PbI2的Ksp=7.0×10-9,现将等体积的KI溶液与Pb(NO3)2溶液混合,当KI的浓度为1×10-2 mol/L时,若要生成沉淀则所需的Pb(NO3)2溶液的最小浓度为 .
①氮元素原子的L层电子数为
②NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为
③肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:N2(g)+2O2(g)═N2O4(l)△H1=-19.5kJ?mol-1
N2H4(l)+O2 (g)═N2(g)+2H2O(g)△H2=-534.2kJ?mol-1
写出肼和N2O4反应的热化学方程式
④写出肼一空气碱性燃料电池放电时正极的反应式为
(2)KI溶液与Pb(NO3)2溶液混合可形成PbI2沉淀,已知PbI2的Ksp=7.0×10-9,现将等体积的KI溶液与Pb(NO3)2溶液混合,当KI的浓度为1×10-2 mol/L时,若要生成沉淀则所需的Pb(NO3)2溶液的最小浓度为
考点:难溶电解质的溶解平衡及沉淀转化的本质,原子核外电子排布,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理
专题:
分析:(1)①依据氮原子的原子序数是7,结合原子结构示意图分析判断;
②NH3与NaClO反应可得到肼(N2H4),依据氧化还原反应化合价变化分析书写化学方程式:
③依据盖斯定律,结合题干热化学方程式计算写出;
④从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2,据此解答即可;
(2)沉淀是PbI2,混合后,c(I-)═5×10-3mol/L,根据Ksp=c[Pb(NO3)2]?c2(I-)计算即可.
②NH3与NaClO反应可得到肼(N2H4),依据氧化还原反应化合价变化分析书写化学方程式:
③依据盖斯定律,结合题干热化学方程式计算写出;
④从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2,据此解答即可;
(2)沉淀是PbI2,混合后,c(I-)═5×10-3mol/L,根据Ksp=c[Pb(NO3)2]?c2(I-)计算即可.
解答:
解:(1)①氮元素原子的原子序数为7,原子的L层电子数为5,故答案为:5;
②NH3与NaClO反应可得到肼(N2H4),次氯酸钠做氧化剂,依据氧化还原反应的电子守恒和原子守恒写出该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
③由①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1,②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ?mol-1根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol,该反应中N2O4的化合价降低,属于氧化剂,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;N2O4;
④肼一空气燃料碱性电池中,正极上空气中的氧气得到电子和水反应生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,故当电池中转移4mol电子时,负极产生N21mol,标况下体积为22.4L,故答案为:O2+4e-+2H2O=4OH-;22.4;
(2)根据题意,沉淀是PbI2,混合后,c(I-)═5×10-3mol/L,根据Ksp=c[Pb(NO3)2]?c2(I-),则生成沉淀时,混合溶液中的Pb(NO3)2溶液的最小浓度为
=2.8×10-4(mol/L),混合前,即原Pb(NO3)2溶液的最小浓度为2×2.8×10-4mol/L=5.6×10-4mol/L.
故答案为:5.6×10-4mol/L.
②NH3与NaClO反应可得到肼(N2H4),次氯酸钠做氧化剂,依据氧化还原反应的电子守恒和原子守恒写出该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
③由①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1,②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ?mol-1根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol,该反应中N2O4的化合价降低,属于氧化剂,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;N2O4;
④肼一空气燃料碱性电池中,正极上空气中的氧气得到电子和水反应生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,故当电池中转移4mol电子时,负极产生N21mol,标况下体积为22.4L,故答案为:O2+4e-+2H2O=4OH-;22.4;
(2)根据题意,沉淀是PbI2,混合后,c(I-)═5×10-3mol/L,根据Ksp=c[Pb(NO3)2]?c2(I-),则生成沉淀时,混合溶液中的Pb(NO3)2溶液的最小浓度为
| 7.0×10-9 |
| (5×10-3)2 |
故答案为:5.6×10-4mol/L.
点评:本题主要考查了原子结构,热化学方程式的书写,盖斯定律的应用,还涉及氧化还原反应原理、溶度积等的计算,具有一定的综合性,题目难度不大.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,下列判断正确的是( )
| A、常温常压下,16g甲烷分子所含质子数为10NA |
| B、1 mol Cl2参加反应转移电子数一定为2NA |
| C、标准状况下,22.4L乙醇的分子数为NA |
| D、1 L 0.01 mol的Na2CO3溶液中含有0.01NA个CO32- |
配制0.1mol/L盐酸溶液480mL,用量筒量取密度为1.19g/cm3质量分数为37%的浓盐酸约(取整数)( )mL注入烧杯中.用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中.
| A、3.5 | B、3.8 |
| C、2.5 | D、4.2 |
 常温下,用 0.1000mol?L-1NaOH溶液滴定 20.00mL 0.1000mol?L-1CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用 0.1000mol?L-1NaOH溶液滴定 20.00mL 0.1000mol?L-1CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )| A、点①所示溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、点②所示溶液中:c(Na+)=c(CH3COO-) |
| C、点③所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| D、滴定过程中可能出现:c(CH3COOH)>c(H+)>c(CH3COO-)>c(Na+)>c(OH-) |
某种烃与H2以物质的量比为1:1加成后的产物是: ,则该烃的结构式可能有( )
,则该烃的结构式可能有( )
 ,则该烃的结构式可能有( )
,则该烃的结构式可能有( )| A、1种 | B、2种 | C、3种 | D、4种 |

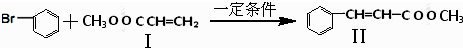

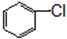 与
与 也可以发生类似反应①的反应,其有机产物的结构简式为
也可以发生类似反应①的反应,其有机产物的结构简式为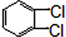 为原料合成
为原料合成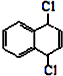 的路线.
的路线.



