题目内容
硫铁矿烧渣是一种重要的化学化工产业中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等.下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m的流程图如图1
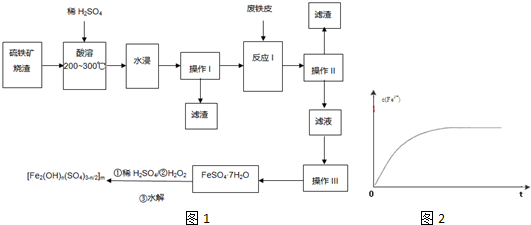
(1)实验室实现“操作I”所用的玻璃仪器有 、玻璃棒和烧杯等.“操作III”系列操作名称依次为 、 、过滤和洗涤.
(2)“酸溶”过程中:
①写出Fe3O4溶于硫酸的化学反应方程式为 .
②某条件下,用足量的酸溶解10g粗颗粒的硫铁矿烧渣,溶液中浓度c(Fe3+)~反应时间t的变化曲线如图2;若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和用细颗粒烧渣反应时c(Fe3+)~t的变化曲线示意图图3进行相应的标注)
(3)实验室检验“反应I”已经完全的试剂是 ,现象是 .
(4)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式 .

(1)实验室实现“操作I”所用的玻璃仪器有
(2)“酸溶”过程中:
①写出Fe3O4溶于硫酸的化学反应方程式为
②某条件下,用足量的酸溶解10g粗颗粒的硫铁矿烧渣,溶液中浓度c(Fe3+)~反应时间t的变化曲线如图2;若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和用细颗粒烧渣反应时c(Fe3+)~t的变化曲线示意图图3进行相应的标注)
(3)实验室检验“反应I”已经完全的试剂是
(4)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:硫铁矿烧渣(主要成分是Fe3O4、Fe2O3、FeO和二氧化硅),加硫酸加热酸溶,水浸,过滤出不溶于酸的二氧化硅,滤液中含有硫酸铁和硫酸亚铁,加废铁皮,Fe与三价铁离子反应生成亚铁离子,过滤去除多余的铁,滤液为硫酸亚铁溶液,然后蒸发浓缩、冷却结晶,得到硫酸亚铁晶体,晶体中加稀硫酸、双氧水得到聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m;
(1)操作I为过滤,根据过滤操作分析;
(2)①Fe3O4溶于硫酸生成硫酸铁和硫酸亚铁;
②降低温度反应速率减小;增大固体的表面积反应速率增大;
(3)反应I中Fe与三价铁离子反应生成亚铁离子,若反应完全则没有三价铁离子;
(4)酸性条件下H2O2氧化Fe2+为Fe3+,同时生成水.
(1)操作I为过滤,根据过滤操作分析;
(2)①Fe3O4溶于硫酸生成硫酸铁和硫酸亚铁;
②降低温度反应速率减小;增大固体的表面积反应速率增大;
(3)反应I中Fe与三价铁离子反应生成亚铁离子,若反应完全则没有三价铁离子;
(4)酸性条件下H2O2氧化Fe2+为Fe3+,同时生成水.
解答:
解:硫铁矿烧渣(主要成分是Fe3O4、Fe2O3、FeO和二氧化硅),加硫酸加热酸溶,水浸,过滤出不溶于酸的二氧化硅,滤液中含有硫酸铁和硫酸亚铁,加废铁皮,Fe与三价铁离子反应生成亚铁离子,过滤去除多余的铁,滤液为硫酸亚铁溶液,然后蒸发浓缩、冷却结晶,得到硫酸亚铁晶体,晶体中加稀硫酸、双氧水得到聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m;
(1)操作I为过滤,过滤操作用到玻璃仪器有 漏斗、玻璃棒和烧杯等;
故答案为:漏斗;
(2)①Fe3O4溶于硫酸生成硫酸铁和硫酸亚铁,反应的化学方程式为:Fe3O4+4H2SO4 FeSO4+Fe2(SO4)3+4H2O;
FeSO4+Fe2(SO4)3+4H2O;
故答案为:Fe3O4+4H2SO4 FeSO4+Fe2(SO4)3+4H2O;
FeSO4+Fe2(SO4)3+4H2O;
②降低温度反应速率减小,反应所用的时间变长,反应完全时铁离子的浓度不变,如图中的曲线3;增大固体的表面积反应速率增大,反应消耗的时间缩短,反应完全时铁离子的浓度不变,如图中的曲线2,降低反应温度和用细颗粒烧渣反应时c(Fe3+)~t的变化曲线示意图为: ;
;
故答案为: ;
;
(3)反应I中Fe与三价铁离子反应生成亚铁离子,若反应完全则没有三价铁离子,检验三价铁离子可以用KSCN溶液,加KSCN溶液,若溶液不变血红色说明没有三价铁离子,即“反应I”已经完全;
故答案为:KSCN溶液;溶液不呈血红色;
(4)酸性条件下H2O2氧化Fe2+为Fe3+,同时双氧水被还原生成水,其反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O.
(1)操作I为过滤,过滤操作用到玻璃仪器有 漏斗、玻璃棒和烧杯等;
故答案为:漏斗;
(2)①Fe3O4溶于硫酸生成硫酸铁和硫酸亚铁,反应的化学方程式为:Fe3O4+4H2SO4
 FeSO4+Fe2(SO4)3+4H2O;
FeSO4+Fe2(SO4)3+4H2O;故答案为:Fe3O4+4H2SO4
 FeSO4+Fe2(SO4)3+4H2O;
FeSO4+Fe2(SO4)3+4H2O;②降低温度反应速率减小,反应所用的时间变长,反应完全时铁离子的浓度不变,如图中的曲线3;增大固体的表面积反应速率增大,反应消耗的时间缩短,反应完全时铁离子的浓度不变,如图中的曲线2,降低反应温度和用细颗粒烧渣反应时c(Fe3+)~t的变化曲线示意图为:
 ;
;故答案为:
 ;
;(3)反应I中Fe与三价铁离子反应生成亚铁离子,若反应完全则没有三价铁离子,检验三价铁离子可以用KSCN溶液,加KSCN溶液,若溶液不变血红色说明没有三价铁离子,即“反应I”已经完全;
故答案为:KSCN溶液;溶液不呈血红色;
(4)酸性条件下H2O2氧化Fe2+为Fe3+,同时双氧水被还原生成水,其反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O.
点评:本题考查制备实验方案的设计与评价,题目难度较大,准确的分析流程、明确铁及其化合物的性质是解题的关键,侧重学生分析能力和创新能力的培养.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
与氨碱法相比较,联合制碱法最突出的优点是( )
| A、设备少 |
| B、原料易得 |
| C、循环利用的物质多 |
| D、NaCl利用率高 |
如图是某燃煤发电厂处理废气的装置示意图.下列说法不正确的是( )

| A、进入烟囱的气体为纯净物 |
| B、此过程中硫元素的化合价没有发生改变 |
| C、使用此废气处理装置可减少酸雨的形成 |
| D、整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2 |


 与
与 也可以发生类似反应①的反应,其有机产物的结构简式为
也可以发生类似反应①的反应,其有机产物的结构简式为 为原料合成
为原料合成 的路线.
的路线.








