题目内容
19.下列关于反应KClO3+6HCl=KCl+3Cl2↑+2H2O的说法不正确的是( )| A. | KClO3是氧化剂 | |
| B. | H2O既不是氧化产物也不是还原产物 | |
| C. | HCl是还原剂 | |
| D. | KCl既是还原产物也是氧化产物 |
分析 KClO3+6HCl=KCl+3Cl2↑+3H2O中,KClO3中Cl元素的化合价由+5价降低为0作氧化剂,HCl中Cl元素的化合价由-1价升高为0作还原剂,以此来解答.
解答 解:A.KClO3中Cl元素的化合价由+5价降低为0,则KClO3是氧化剂,故A正确;
B.H、O元素的化合价不变,则H2O既不是氧化产物也不是还原产物,故B正确;
C.HCl中Cl元素的化合价由-1价升高为0,则HCl为还原剂,故C正确;
D.氯气既是还原产物也是氧化产物,KCl中元素的化合价不变,则KCl既不是氧化产物也不是还原产物,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
14.将一定量的氯气通入60mL浓度为10.00mol/L的热的氢氧化钠浓溶液中,溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断不正确的是( )
| A. | 与NaOH反应的氯气一定为0.3 mol | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.3<n<0.5 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 |
11.下列物质的类别与所含官能团都正确的是( )
| A. | 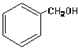 酚类-OH 酚类-OH | B. | 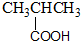 羧酸-CHO 羧酸-CHO | ||
| C. | 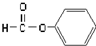 醛类-CHO 醛类-CHO | D. | CH3-O-CH3 醚类 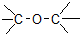 |
8.下列化学方程式中,能用离子方程式 H++OH-=H2O 表示的是( )
| A. | H2SO4+Ba(OH)2=BaSO4↓+2H2O | B. | HCl+NaOH=NaCl+H2O | ||
| C. | NaOH+CH3COOH=CH3COONa+H2O | D. | Cu(OH)2+2HCl=CuCl2+2H2O |
9.化学反应 A2+B2═2AB 的能量变化如图所示,则下列说法中正确的是( )
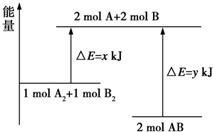

| A. | 该反应过程吸收能量 | |
| B. | 断裂 1molA-A 键和 1molB-B 键可放出 x kJ 能量 | |
| C. | 形成 2molA-B 键需要放出 y kJ 能量 | |
| D. | 2molAB 的总能量高于 1molA2和 1molB2的总能量 |
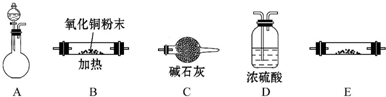
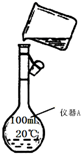 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:
 .
.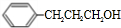
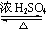
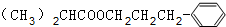 +H2O.
+H2O. .
.