题目内容
3.下列电离方程式书写正确的是( )| A. | H2SO4═2H++4SO2- | B. | CuSO4═Cu++SO4- | C. | Ba(OH)2═Ba2++2OH- | D. | FeCl3═Fe2++3Cl- |
分析 A、硫酸电离出氢离子和硫酸根离子,硫酸根离子不能拆;
B、硫酸铜电离出铜离子和硫酸根;
C、氢氧化钡是强碱,能完全电离为钡离子和氢氧根;
D、氯化铁完全电离为铁离子和氯离子.
解答 解:A、硫酸为二元强酸,是强电解质在水中完全电离,电离方程式为:H2SO4═2H++SO42-,故A错误;
B、硫酸铜电离出铜离子和硫酸根,铜离子为+2价,硫酸根为-2价,故电离方程式为:CuSO4═Cu2++SO42-,故B错误;
C、氢氧化钡是强碱,能完全电离为钡离子和2个氢氧根,Ba(OH)2═Ba2++2OH-,故C正确;
D、氯化铁完全电离为铁离子和3个氯离子,故电离方程式为:FeCl3=Fe3++3Cl-,故D错误.
故选C.
点评 本题考查了电离方程式的书写判断,题目难度不大,注意掌握强电解质、弱电解质的判断方法,明确电离方程式的书写原则为解答关键,试题培养了学生规范答题的能力.

练习册系列答案
相关题目
13.除去蛋清中混有的少量Cl-的方法是( )
| A. | 加入少量硝酸银溶液 | B. | 过滤 | ||
| C. | 电泳 | D. | 渗析 |
14.将一定量的氯气通入60mL浓度为10.00mol/L的热的氢氧化钠浓溶液中,溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断不正确的是( )
| A. | 与NaOH反应的氯气一定为0.3 mol | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.3<n<0.5 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 |
11.下列物质的类别与所含官能团都正确的是( )
| A. | 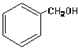 酚类-OH 酚类-OH | B. | 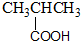 羧酸-CHO 羧酸-CHO | ||
| C. | 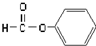 醛类-CHO 醛类-CHO | D. | CH3-O-CH3 醚类 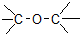 |
18.下列各组混合物,总质量一定,当以不同比例混合时,完全燃烧生成CO2的质量不同的是( )
| A. | 苯、甲苯 | B. | 乙炔、苯乙烯 | C. | 甲醛、甲酸甲酯 | D. | 甲烷、辛醛 |
8.下列化学方程式中,能用离子方程式 H++OH-=H2O 表示的是( )
| A. | H2SO4+Ba(OH)2=BaSO4↓+2H2O | B. | HCl+NaOH=NaCl+H2O | ||
| C. | NaOH+CH3COOH=CH3COONa+H2O | D. | Cu(OH)2+2HCl=CuCl2+2H2O |
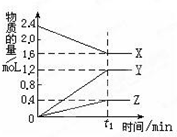 某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.
某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.