题目内容
20.重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过):制备原理:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)制备过程总的离子方程式可表示为4CrO42-+4H2O═2Cr2O72-+4OH-+2H2↑+O2↑,通电后阳极室产生的现象为阳极产生无色气体,溶液由黄色逐渐变为橙色,其电极反应式是4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4 H+.
(2)若实验开始时在右室中加入0.2mol K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为2:1.
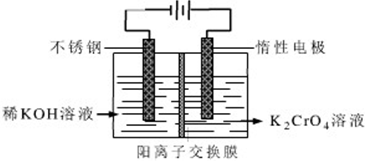
分析 (1)电解时,阳极上OH-放电生成生成O2,同时阳极附近有H+生成,导致溶液呈酸性,酸性条件下发生反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,导致溶液由黄色转化为橙色;
(2)电解过程中阳极附近有氢离子生成,左室中的钾离子通过阳离子交换膜进入右室,导致右室中钾原子物质的量增大,根据Cr原子守恒进行计算.
解答 解:(1)电解时,阳极上OH-放电生成生成O2,电极反应式为4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4 H+;同时阳极附近有H+生成,导致溶液呈酸性,酸性条件下发生反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,导致溶液由黄色转化为橙色,所以看到的现象是阳极产生无色气体,溶液由黄色逐渐变为橙色,
故答案为:阳极产生无色气体,溶液由黄色逐渐变为橙色;4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4 H+;
(2)电解过程中阳极附近有氢离子生成,左室中的钾离子通过阳离子交换膜进入右室,导致右室中钾原子物质的量增大,开始时在右室中加入0.2mol K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,根据Cr原子守恒知,则t分钟后K、Cr的物质的量分别是0.3mol、0.2mol,
设溶液中K2CrO4和K2Cr2O7的物质的量分别是xmol、ymol,
则$\left\{\begin{array}{l}{2x+2y=0.3}\\{x+2y=0.2}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.1}\\{y=0.05}\end{array}\right.$,
所以溶液中K2CrO4和K2Cr2O7的物质的量之比=0.1mol:0.05mol=2:1,
故答案为:2:1.
点评 本题以电解原理为载体考查化学平衡影响因素、物质的量的计算,为高频考点,明确各个电极上发生的反应是解本题关键,知道电解质溶液中离子移动方向,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 食用花生油、鸡蛋清和葡萄糖都能发生水解反应 | |
| B. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都含有不饱和碳碳双键 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
| A. | SO2+2NaOH═Na2SO3+H2O | B. | SO2+H2O+(NH4)2SO3═2NH4HSO3 | ||
| C. | SO2+N02═SO3+NO | D. | SO2+H2O+Br2═H2SO4+2HBr |
| A. | 实验前试管先用热的烧碱溶液洗涤,再用蒸馏水洗涤 | |
| B. | 向2%的硝酸银溶液中滴入2%的稀氨水,直至产生的沉淀恰好溶解,配得银氨溶液 | |
| C. | 采用水浴加热,不能直接加热 | |
| D. | 可用浓盐酸洗去银镜 |
| A. | 加入盐酸 | B. | 通入CO2 | ||
| C. | 加热至固体质量不再减少为止 | D. | 加入NaOH溶液 |
| A. | 二氧化氮 | B. | 钠 | C. | 硫酸镁 | D. | 二氧化硅 |
| A. | 太阳能蓄电池只是将太阳能直接转化为电能的装置 | |
| B. | 燃料电池是将化学能直接转化为电能的装置,所以能量利用率高 | |
| C. | 碱性Zn-Mn干电池比酸性Zn-Mn干电池耐用,且不易漏液 | |
| D. | 手机上用的锂离子电池属于二次电池 |
| A. | H2O、NH3•H2O、H3PO4 | B. | Cu(OH)2、CH3COOH、C2H5OH | ||
| C. | H2SO3、Ba(OH)2、BaSO4 | D. | H2SiO3、H2S、CO2 |
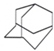 金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.判断由氯原子取代金刚烷中的亚甲基(-CH2-)中的氢原子所形成的二氯代物的种类有( )
金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.判断由氯原子取代金刚烷中的亚甲基(-CH2-)中的氢原子所形成的二氯代物的种类有( )