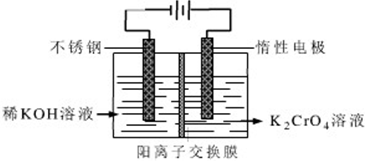
题目内容
5.下列物质与水作用形成的物质能与氯化铵作用形成氨气的是( )| A. | 二氧化氮 | B. | 钠 | C. | 硫酸镁 | D. | 二氧化硅 |
分析 铵盐能与碱反应生成氨气,依据二氧化氮、钠、硫酸镁、二氧化硅性质解答.
解答 解:A.二氧化氮与水反应生成硝酸,硝酸与氯化铵不反应,故A不选;
B.钠与水反应生成氢氧化钠,氢氧化钠与氯化铵反应生成氨气,故B选;
C.硫酸镁与水不反应,故C错误;
D.二氧化硅不溶液水,故D错误;
故选:B.
点评 本题考查了元素化合物知识,熟悉铵盐的性质是解题关键,题目难度不大,注意对基础知识积累.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
3.在下列各组离子中,能大量共存的且溶液呈无色是( )
| A. | Na+、H+、Al3+、CH3COO- | B. | Mg2+、HCO3-、Ca2+、NO3- | ||
| C. | K+、SO42-、Cl-、Cu2+ | D. | NH4+、Cl-、K+、OH- |
4.下列各组物质中属于同分异构体的是( )
| A. |  和 和 | B. |  与 与 | ||
| C. |  与 与 | D. |  与 与 |
14.在标准状况下进行甲、乙、丙三组实验.三组实验均各取20mL同浓度的盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见下表:
请回答下列问题:
(1)甲、乙两组实验中,哪一组盐酸是不足量的?乙(填“甲”或“乙”).理由是因甲反应后的溶液中再加合金还能继续反应,说明甲中盐酸有剩余,若乙中盐酸恰好完全反应或有剩余,则产生的氢气应为$\frac{385}{255}$×280mL=423mL>336mL,故说明乙中盐酸不足.
(2)要算出盐酸的物质的量浓度,题中可作为计算依据的数据是乙或丙,求得的盐酸的物质的量浓度为1.5mol/L.
(3)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是甲,求得的Mg、Al物质的量之比为1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(1)甲、乙两组实验中,哪一组盐酸是不足量的?乙(填“甲”或“乙”).理由是因甲反应后的溶液中再加合金还能继续反应,说明甲中盐酸有剩余,若乙中盐酸恰好完全反应或有剩余,则产生的氢气应为$\frac{385}{255}$×280mL=423mL>336mL,故说明乙中盐酸不足.
(2)要算出盐酸的物质的量浓度,题中可作为计算依据的数据是乙或丙,求得的盐酸的物质的量浓度为1.5mol/L.
(3)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是甲,求得的Mg、Al物质的量之比为1:1.
15.某无色混合气体甲,可能含NO、NO2、NH3、CO2、N2中的几种,将100mL气体甲依次经过如图所示的实验处理,结果得到酸性溶液且最终无剩余气体.则气体甲的组成为( )
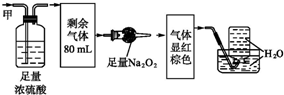

| A. | NH320ml、NO240ml、N240ml | B. | NH3 20ml、NO32ml、CO248ml | ||
| C. | NH320ml、NO20ml、CO260ml | D. | NH320ml、CO228ml、NO52ml |
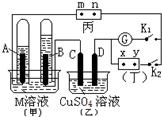 如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:
如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题: