题目内容
10.X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收.已知X是化石燃料燃烧的产物之一,是形成酸雨的主要物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应.请写出下列反应的化学方程式.(1)X溶于雨水,形成酸雨SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4;
(2)Y与NaOH溶液反应Cl2+2NaOH═NaCl+NaClO+H2O;
(3)Z与水反应3NO2+H2O=2HNO3+NO.
分析 X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收,说明这三种气体能和碱反应,X是化石燃料燃烧的产物之一,是形成酸雨的主要物质,化石中含有S元素,二氧化硫和氮氧化物是酸性酸雨的主要气体,所以X是SO2;Y是一种单质,它的水溶液具有漂白作用,氯气和水反应生成的次氯酸具有漂白性,所以Y是Cl2;Z是硝酸工业和汽车尾气中的有害物质之一,汽车尾气中含有一氧化氮和二氧化氮,能与水反应的氮氧化物是二氧化氮,则Z是NO2,以此解答该题.
解答 解:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收,说明这三种气体能和碱反应,X是化石燃料燃烧的产物之一,是形成酸雨的主要物质,化石中含有S元素,二氧化硫和氮氧化物是酸性酸雨的主要气体,所以X是SO2;Y是一种单质,它的水溶液具有漂白作用,氯气和水反应生成的次氯酸具有漂白性,所以Y是Cl2;Z是硝酸工业和汽车尾气中的有害物质之一,汽车尾气中含有一氧化氮和二氧化氮,能与水反应的氮氧化物是二氧化氮,则Z是NO2,
(1)X是二氧化硫,在催化剂、加热条件下,二氧化硫和氧气反应生成三氧化硫,反应方程式为SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4,
故答案为:SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4;
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应方程式为Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(3)二氧化氮和水反应生成硝酸和一氧化氮,反应方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO.
点评 本题考查无机物的推断,为高频考点,题目综合考查元素化合物知识,熟悉二氧化硫、氯气、二氧化氮的性质是解题关键,注意对基础知识的积累,题目难度不大.

| A. | CH3CH=CH(CH2)2CH3 | B. | CH2=CH(CH2)2CH3 | ||
| C. | CH3CH2 CH=CH2 | D. | CH3CH2CH=CHCH2CH3 |
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入具有还原性 的维生素C,可防止该现象发生 | |
| C. | 用NaOH溶液和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
| A. | NaHCO3═Na++HCO3- | B. | NaHSO4═Na++H++SO42- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | H3PO4?3H++PO43- |
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 强电解质溶液不一定比弱电解质的导电性强 | |
| C. | HR型共价化合物一定是强电解质 | |
| D. | 强、弱电解质的导电性只由它们溶液的浓度决定 |
| A. | X的金属性比Y的金属性强 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X 元素的氢氧化物碱性弱 | |
| D. | X元素的最高化合价比Y 元素的最高化合价高 |
| A. | H2S的电子式: | B. | Mg2+的结构示意图: | ||
| C. | Na2O的电子式: | D. | N2的电子式: |
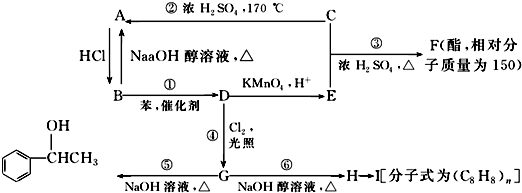
 ,E
,E .
.

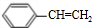 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.