题目内容
20.下列化学用语正确的是( )| A. | H2S的电子式: | B. | Mg2+的结构示意图: | ||
| C. | Na2O的电子式: | D. | N2的电子式: |
分析 A.硫化氢为共价化合物,分子中不存在阴阳离子;
B.镁离子的核电荷数为12,核外电子总数为10;
C.氧化钠的电子式中,两个钠离子不能合并;
D.氮气分子中含有1个氮氮三键,N原子最外层满足8电子稳定结构.
解答 解:A.H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,正确的电子式为 ,故A错误;
,故A错误;
B.Mg2+的质子数为12,电子数为10,离子结构示意图为: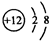 ,故B错误;
,故B错误;
C.氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为 ,故C错误;
,故C错误;
D.N2分子中含有1个氮氮三键,其电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的分析能力及规范答题能力.

练习册系列答案
相关题目
11.100mL 6mol•L-1H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A. | 碳酸钠(固体) | B. | 少量硫酸铜溶液 | C. | Na2SO4溶液 | D. | 加热 |
8.下列离子在特定条件下,能够大量共存的是( )
| A. | 含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在强碱的溶液中:Na+、K+、ClO-、SO32- | |
| C. | 在强酸的溶液中:K+、Fe3+、Cl-、NO3- | |
| D. | 在强碱的溶液中:K+、Na+、Ca2+、HCO3- |
15.NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,生成N2和CO2.对此反应,下列叙述正确的是( )
| A. | 使用催化剂能加快反应 | B. | 升高温度能增大反应的速率 | ||
| C. | 改变压强对反应速率没有影响 | D. | 降低温度能加快反应 |
5.下列叙述正确的是( )
| A. | 烃类分子中的碳原子与其他原子间通过非极性键结合 | |
| B. | 烷烃是饱和的链烃,分子中碳原子不可能在同一平面上 | |
| C. | 甲烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气 | |
| D. | 烷烃的沸点随碳原子数增加而逐渐升高 |
12.用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
| A. | 常温常压下,46g有机物C2H6O中含有极性共价键的数目一定为7NA | |
| B. | 标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA | |
| C. | 常温常压下,14g乙烯和丙烯的混合气体中含有的原子总数为3NA | |
| D. | 标准状况下,1mol苯分子中含有碳碳双键的数目为3NA |
9.对于16g氧气,下列描述正确的是( )
| A. | 1mol O2 | B. | 1mol O | C. | 含3.01×1023个O2 | D. | 含3.01×1023个O |
2.下列说法不正确的是( )
| A. | 除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、蒸馏 | |
| B. | 除去溴苯中混有的少量单质溴:加入足量的NaOH溶液,振荡、静置、分液 | |
| C. | CH4和CCl4中的化学键均为非极性键,CH4、CCl4都是正四面体结构 | |
| D. | 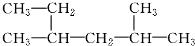 系统命名法为:2,4-二甲基-己烷 系统命名法为:2,4-二甲基-己烷 |