题目内容
11.下列物质:①氢氧化钠固体 ②水银 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠⑩CuSO4•5H2O晶体
a.上述状态下能导电的是:②④⑥⑨b.属于电解质的是:①③⑦⑨⑩c.属于非电解质的是:⑤⑧.
分析 能导电的物质含有自由移动的电子或阴阳离子;
电解质是指:在水溶液中或熔融状态下能够导电的化合物;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子;
单质,混合物既不是电解质也不是非电解质,根据定义即可解答.
解答 解:a.②水银含有自由移动的电子,所以能导电,④稀硫酸、⑥氨水、⑨熔融氯化钠中含有自由移动的阴、阳离子,所以能导电;
故答案为:②④⑥⑨;
b.①氢氧化钠固体、③氯化氢气体、⑦碳酸钠粉末、⑨熔融氯化钠、⑩胆矾在水溶液里或熔融状态下能电离出阴阳离子,所以是电解质;
故答案为:①③⑦⑨⑩;
c.⑤CO2在水溶液中与水反应生成碳酸,碳酸电离出自由移动的氢离子和碳酸氢根离子,溶液导电,CO2自身不能电离,CO2是非电解质;⑧是化合物,但其水溶液只存在蔗糖分子,不导电,属于非电解质;
故答案为:⑤⑧.
点评 本题考查了电解质和非电解质的判断及能导电的物质,注意能导电的物质不一定是电解质,电解质不一定导电,为易错点,题目难度不大.

练习册系列答案
相关题目
1.已知热化学方程式 N2(g)+3H2(g)?2NH3(g)△H=-Q kJ•mol-1(Q>0),下列说法中,正确的是
( )
( )
| A. | 1mol N2(g)和 3mol H2(g)具有的能量之和低于 2 mol NH3(g)具有的能量 | |
| B. | 将 1mol N2(g)和 3mol H2(g)置于一密闭容器中充分反应后放出 Q kJ 的热量 | |
| C. | 升高温度,平衡向逆反应方向移动,上述热化学方程式中的 Q 值减小 | |
| D. | 将一定量 N2、H2置于某密闭容器中充分反应放热 Q kJ,则此过程中有 3mol H2被氧化 |
2.用下列方案配制物质的量浓度为0.1mol/L的溶液,其中可行的是( )
| A. | 将4 g NaOH溶解在1L蒸馏水中 | |
| B. | 用托盘天平称量5.85g NaCl固体溶于蒸馏水,配成1000mL溶液 | |
| C. | 常温常压下,将11.2L HCl气体溶于蒸馏水,配成500mL溶液 | |
| D. | 取50 mL 0.5mol/L 的KNO3溶液用蒸馏水稀释,配成250mL 溶液 |
19.下列表示氧化还原反应实质正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
6.设NA为阿伏加德罗常数.下列关于0.2mol•L-1 Ba(NO3)2溶液的说法不正确的是(忽略水的电离)( )
| A. | 1 L溶液中含阴、阳离子总数是0.6 NA | |
| B. | 500 mL溶液中Ba2+的浓度是0.2 mol•L-1 | |
| C. | 500 mL溶液中NO-3的浓度是0.4 mol•L-1 | |
| D. | 1 L溶液中含有0.2 NA个NO3- |
3.由丙三醇和甲苯混合经过特殊技术可形成蒸汽组成的混合气体中,若其中混合蒸汽中碳元素的质量分数为50%,则氧元素的质量分数为( )
| A. | 41.3% | B. | 8.7% | C. | 1.74% | D. | 2.14% |
20.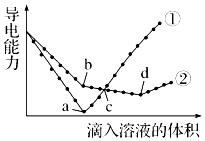 常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
 常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | ①代表滴加H2SO4溶液的变化曲线 | B. | b点,水电离产生的c(H+)<10-7mol/L | ||
| C. | c点,两溶液中含有相同量的 OH- | D. | a、d两点对应的溶液均显中性 |
7.碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等. 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:
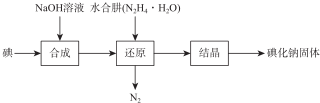
已知:N2H4•H2O在100℃以上分解.
(1)已知,在合成过程的反应产物中含有NalO3,则在合成过程中消耗了3mol I2,所生成 NalO3的物质的量为1mol.
(2)写出还原过程中的离子方程式2IO3-+3N2H4•H2O═3N2+2I-+9H2O;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过100℃;请选择下列试剂检测所得碘化钠固体中是否含有NalO3杂质BD(选填字母).
A.FeCl2溶液 B.冰醋酸
C.CKI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol•L-1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3+I2═Na2S4O2+2NaI),重复测定2次,所得的相关数据如下表:
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为2Fe3++2I-═2Fe2++I2.
②加入A物质为淀粉试液(填名称);滴定终点观察到的现象为溶液由浅蓝色褪色,且半分钟内不变色.
③计算该样品中NaI的含量为90%.
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是密封保存.

已知:N2H4•H2O在100℃以上分解.
(1)已知,在合成过程的反应产物中含有NalO3,则在合成过程中消耗了3mol I2,所生成 NalO3的物质的量为1mol.
(2)写出还原过程中的离子方程式2IO3-+3N2H4•H2O═3N2+2I-+9H2O;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过100℃;请选择下列试剂检测所得碘化钠固体中是否含有NalO3杂质BD(选填字母).
A.FeCl2溶液 B.冰醋酸
C.CKI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol•L-1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3+I2═Na2S4O2+2NaI),重复测定2次,所得的相关数据如下表:
| 测定 序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
②加入A物质为淀粉试液(填名称);滴定终点观察到的现象为溶液由浅蓝色褪色,且半分钟内不变色.
③计算该样品中NaI的含量为90%.
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是密封保存.