题目内容
1.已知热化学方程式 N2(g)+3H2(g)?2NH3(g)△H=-Q kJ•mol-1(Q>0),下列说法中,正确的是( )
| A. | 1mol N2(g)和 3mol H2(g)具有的能量之和低于 2 mol NH3(g)具有的能量 | |
| B. | 将 1mol N2(g)和 3mol H2(g)置于一密闭容器中充分反应后放出 Q kJ 的热量 | |
| C. | 升高温度,平衡向逆反应方向移动,上述热化学方程式中的 Q 值减小 | |
| D. | 将一定量 N2、H2置于某密闭容器中充分反应放热 Q kJ,则此过程中有 3mol H2被氧化 |
分析 A.该反应为放热反应,反应物总能量高;
B.合成氨反应为可逆反应,不能完全转化;
C.为放热反应,升高温度逆向移动,但反应的△H不变;
D.物质的量与反应中的能量变化成正比.
解答 解:A.该反应为放热反应,1mol N2(g)和 3mol H2(g)具有的能量之和高于 2 mol NH3(g)具有的能量,故A错误;
B.合成氨反应为可逆反应,不能完全转化,则将 1mol N2(g)和 3mol H2(g)置于一密闭容器中充分反应后放出热量小于 Q kJ,故B错误;
C.为放热反应,升高温度逆向移动,但反应的△H不变,即上述热化学方程式中的 Q 值不变,故C错误;
D.物质的量与反应中的能量变化成正比,则一定量 N2、H2置于某密闭容器中充分反应放热 Q kJ,则此过程中有 3mol H2被氧化,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应的特点、平衡移动、反应中能量变化为解答的关键,侧重分析与应用能力的考查,注意物质的量与能量的关系,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
12.CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉.工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
FeSO4$\underset{\stackrel{\;}{→}}{①}$FeOOH$\underset{\stackrel{\;}{→}}{②}$Fe2O3$\underset{\stackrel{\;}{→}}{③}$Fe3O4$\underset{\stackrel{CuS{O}_{4}溶液④}{→}}{\;}$CoxFe3-xO4
回答下列问题:
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH.生成FeOOH的化学方程式为4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O.
(2)步骤②将FeOOH在200~300℃下加热脱水,生成红色Fe2O3.实验室完成该操作需要下列仪器中的cde(填字母).
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤③通入H2,加热至300~400℃,生成Fe3O4.通入H2前要向加热炉中通入N2,其作用为除去空气,防止氢气与氧气混合反应爆炸.
(4)步骤④加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品.检验粗产品是否洗涤干净的实验操作和现象是取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净;后发现滤液浑浊,请写出原因(一点即可)玻璃棒抵住滤纸时滤纸破裂、原液液面高于滤纸边缘.
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的+2价和+3价的氧化物)制备CoSO4•7H2O晶体.已知在酸性条件下不稳定极易变成两价钴离子,下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝.
②用稀硫酸溶解LiCoO2,并加入过量H2O2.
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤.
④向③所得滤液中加入NaOH溶液,调节pH至9.4,过滤,洗涤得到Co(OH)2沉淀.
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、冷却结晶(填实验步骤),得到CoSO4•7H2O晶体.若欲再提纯,可以通过重结晶(填实验步骤).
FeSO4$\underset{\stackrel{\;}{→}}{①}$FeOOH$\underset{\stackrel{\;}{→}}{②}$Fe2O3$\underset{\stackrel{\;}{→}}{③}$Fe3O4$\underset{\stackrel{CuS{O}_{4}溶液④}{→}}{\;}$CoxFe3-xO4
回答下列问题:
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH.生成FeOOH的化学方程式为4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O.
(2)步骤②将FeOOH在200~300℃下加热脱水,生成红色Fe2O3.实验室完成该操作需要下列仪器中的cde(填字母).
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤③通入H2,加热至300~400℃,生成Fe3O4.通入H2前要向加热炉中通入N2,其作用为除去空气,防止氢气与氧气混合反应爆炸.
(4)步骤④加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品.检验粗产品是否洗涤干净的实验操作和现象是取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净;后发现滤液浑浊,请写出原因(一点即可)玻璃棒抵住滤纸时滤纸破裂、原液液面高于滤纸边缘.
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的+2价和+3价的氧化物)制备CoSO4•7H2O晶体.已知在酸性条件下不稳定极易变成两价钴离子,下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝.
②用稀硫酸溶解LiCoO2,并加入过量H2O2.
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤.
④向③所得滤液中加入NaOH溶液,调节pH至9.4,过滤,洗涤得到Co(OH)2沉淀.
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、冷却结晶(填实验步骤),得到CoSO4•7H2O晶体.若欲再提纯,可以通过重结晶(填实验步骤).
9.下列有关能量转化的认识,不正确的是( )
| A. | 植物的光合作用使得太阳能转化为化学能 | |
| B. | 人类使用照明设备是将电能转化为光能 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 燃料燃烧时只是将化学能转化为热能 |
16.下列有关化学反应与能量变化的说法正确的是( )
| A. | 甲烷的燃烧热△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+$\frac{3}{2}$O2(g)=CO(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 中和热测定实验中的终止温度就是实验过程中混合液的最高温度 | |
| C. | 为了减少大气中的雾霾,天然气日渐成为一种备受关注的可再生的清洁能源 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
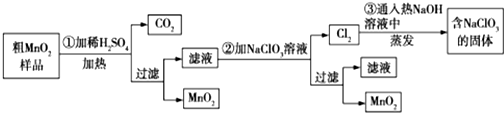
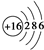 .
. ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.