题目内容
2.用下列方案配制物质的量浓度为0.1mol/L的溶液,其中可行的是( )| A. | 将4 g NaOH溶解在1L蒸馏水中 | |
| B. | 用托盘天平称量5.85g NaCl固体溶于蒸馏水,配成1000mL溶液 | |
| C. | 常温常压下,将11.2L HCl气体溶于蒸馏水,配成500mL溶液 | |
| D. | 取50 mL 0.5mol/L 的KNO3溶液用蒸馏水稀释,配成250mL 溶液 |
分析 A.1L蒸馏水为溶剂的体积;
B.托盘天平的感量为0.1g;
C.常温常压下,Vm≠22.4L/mol,n=$\frac{V}{Vm}$、c=$\frac{n}{V}$;
D.稀释前后溶质的物质的量不变.
解答 解:A.1L蒸馏水为溶剂的体积,溶液体积未知,不能计算浓度,故A错误;
B.托盘天平的感量为0.1g,不能称量5.85gNaCl,故B错误;
C.常温常压下,Vm≠22.4L/mol,不能由n=$\frac{V}{Vm}$、c=$\frac{n}{V}$计算浓度,故C错误;
D.稀释前后溶质的物质的量不变,则250mL溶液的浓度c=$\frac{0.05L×0.5mol/L}{0.25L}$=0.1mol/L,故D正确;
故选D.
点评 本题考查溶液配制实验的评价,为高频考点,把握物质的量浓度、体积、物质的量的关系为解答的关键,侧重分析与实验能力的考查,注意实验数据及实验评价性分析,题目难度不大.

练习册系列答案
相关题目
12.CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉.工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
FeSO4$\underset{\stackrel{\;}{→}}{①}$FeOOH$\underset{\stackrel{\;}{→}}{②}$Fe2O3$\underset{\stackrel{\;}{→}}{③}$Fe3O4$\underset{\stackrel{CuS{O}_{4}溶液④}{→}}{\;}$CoxFe3-xO4
回答下列问题:
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH.生成FeOOH的化学方程式为4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O.
(2)步骤②将FeOOH在200~300℃下加热脱水,生成红色Fe2O3.实验室完成该操作需要下列仪器中的cde(填字母).
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤③通入H2,加热至300~400℃,生成Fe3O4.通入H2前要向加热炉中通入N2,其作用为除去空气,防止氢气与氧气混合反应爆炸.
(4)步骤④加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品.检验粗产品是否洗涤干净的实验操作和现象是取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净;后发现滤液浑浊,请写出原因(一点即可)玻璃棒抵住滤纸时滤纸破裂、原液液面高于滤纸边缘.
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的+2价和+3价的氧化物)制备CoSO4•7H2O晶体.已知在酸性条件下不稳定极易变成两价钴离子,下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝.
②用稀硫酸溶解LiCoO2,并加入过量H2O2.
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤.
④向③所得滤液中加入NaOH溶液,调节pH至9.4,过滤,洗涤得到Co(OH)2沉淀.
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、冷却结晶(填实验步骤),得到CoSO4•7H2O晶体.若欲再提纯,可以通过重结晶(填实验步骤).
FeSO4$\underset{\stackrel{\;}{→}}{①}$FeOOH$\underset{\stackrel{\;}{→}}{②}$Fe2O3$\underset{\stackrel{\;}{→}}{③}$Fe3O4$\underset{\stackrel{CuS{O}_{4}溶液④}{→}}{\;}$CoxFe3-xO4
回答下列问题:
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH.生成FeOOH的化学方程式为4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O.
(2)步骤②将FeOOH在200~300℃下加热脱水,生成红色Fe2O3.实验室完成该操作需要下列仪器中的cde(填字母).
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤③通入H2,加热至300~400℃,生成Fe3O4.通入H2前要向加热炉中通入N2,其作用为除去空气,防止氢气与氧气混合反应爆炸.
(4)步骤④加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品.检验粗产品是否洗涤干净的实验操作和现象是取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净;后发现滤液浑浊,请写出原因(一点即可)玻璃棒抵住滤纸时滤纸破裂、原液液面高于滤纸边缘.
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的+2价和+3价的氧化物)制备CoSO4•7H2O晶体.已知在酸性条件下不稳定极易变成两价钴离子,下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝.
②用稀硫酸溶解LiCoO2,并加入过量H2O2.
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤.
④向③所得滤液中加入NaOH溶液,调节pH至9.4,过滤,洗涤得到Co(OH)2沉淀.
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、冷却结晶(填实验步骤),得到CoSO4•7H2O晶体.若欲再提纯,可以通过重结晶(填实验步骤).
17.某硫酸试剂瓶上的标签如图所示,某同学从瓶中倒出50mL用于配制稀硫酸,求:
(1)50mL该浓硫酸的质量为90.5g,其中含溶质88.69g,物质的量浓度是18.1mol•L-1.
(2)将50mL该浓硫酸与200mL水均匀混合,所得稀硫酸的质量分数是多少?
| 浓硫酸(H2SO4)500mL | |
| 浓度(质量分数) | 98% |
| 密度 | 1.81g•cm-3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封贮藏 | |
(2)将50mL该浓硫酸与200mL水均匀混合,所得稀硫酸的质量分数是多少?
12.除去下列物质中的杂质选用的试剂和方法最合理的是( )
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 氯化铁溶液 | 氯化亚铁 | 过量铁粉 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和NaHCO3溶液 | 洗气 |
| C | 二氧化硅 | 氧化铝 | 氨水 | 过滤 |
| D | 氯化钠溶液 | 碘化钠 | 四氯化碳 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
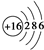 .
. ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.