题目内容
下表(图1)是元素周期表的一部分.表中所列的字母分别代表一种化学元素
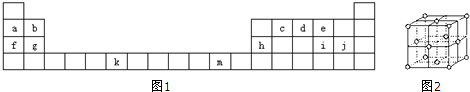
试回答下列问题:
(1)d的基态原子电子排布图为 ;k的外围电子排布式为
(2)ci2的结构式为 ;ci2与ce2比较,沸点较低的是 (写化学式)
(3)m的晶体的晶胞如图2所示,则一个晶胞中m原子的个数 个.每一个m周围有 个M与其相邻且距离相等.
(4)根据等电子体原理,写出与d2互为等电子体的粒子 、 (写化学式)
(5)下列关于元素在元素周期表中的位置的叙述正确的是 .
A.m位于元素周期表中第四周期、ⅡB族,属于ds区元素;
B.k位于元素周期表中第四周期、ⅣB族,属于d区元素;
C.g位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.j位于元素周期表中第三周期、ⅦA族,属于ds区元素;
(6)将氨水逐滴滴入到m的硫酸盐溶液中,直至过量,现象 ,若加入极性较小的溶剂乙醇,现象 .写出反应过程中总的离子方程式 .

试回答下列问题:
(1)d的基态原子电子排布图为
(2)ci2的结构式为
(3)m的晶体的晶胞如图2所示,则一个晶胞中m原子的个数
(4)根据等电子体原理,写出与d2互为等电子体的粒子
(5)下列关于元素在元素周期表中的位置的叙述正确的是
A.m位于元素周期表中第四周期、ⅡB族,属于ds区元素;
B.k位于元素周期表中第四周期、ⅣB族,属于d区元素;
C.g位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.j位于元素周期表中第三周期、ⅦA族,属于ds区元素;
(6)将氨水逐滴滴入到m的硫酸盐溶液中,直至过量,现象
考点:元素周期律和元素周期表的综合应用
专题:
分析:(1)d为N元素,是7号元素,根据核外电子排布规律书写氮原子的电子排布图;k为Cr元素,是25元素,根据核外电子排布规律书写Cr原子的外围电子排布式;
(2)ci2与ce2分别为:CS2、CO2,CS2分子中C原子与S原子之间形成2对共用电子对;常温下,CS2为液态体,CO2为气态;
(3)根据均摊法计算,顶点占
,面心占
;
(4)等电子体是指原子个数相同,价电子总数相同,据此写出;
(5)A.Cu位于元素周期表中第四周期ⅠB族,属于ds区元素;
B.Cr元素原子外围电子排布为3d54s1,位于第四周期、ⅥB族,属于ds区元素;
C.g为镁元素,位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.j 为氯元素,位于元素周期表中第三周期、ⅦA族,属于p区元素;
(6)将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到四氨合铜络离子,溶液呈深蓝色,从降低物质的溶解度的角度来分析晶体的析出.
(2)ci2与ce2分别为:CS2、CO2,CS2分子中C原子与S原子之间形成2对共用电子对;常温下,CS2为液态体,CO2为气态;
(3)根据均摊法计算,顶点占
| 1 |
| 8 |
| 1 |
| 2 |
(4)等电子体是指原子个数相同,价电子总数相同,据此写出;
(5)A.Cu位于元素周期表中第四周期ⅠB族,属于ds区元素;
B.Cr元素原子外围电子排布为3d54s1,位于第四周期、ⅥB族,属于ds区元素;
C.g为镁元素,位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.j 为氯元素,位于元素周期表中第三周期、ⅦA族,属于p区元素;
(6)将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到四氨合铜络离子,溶液呈深蓝色,从降低物质的溶解度的角度来分析晶体的析出.
解答:
解:(1)d为N元素,是7号元素,氮原子的电子排布图为 ;
;
k为Cr元素,是25元素,Cr原子的电子排布式为1s22s22p63s23p63d54s1,外围电子排布为:3d54s1;
故答案为: ;3d54s1;
;3d54s1;
(2)ci2与ce2分别为:CS2、CO2,CS2分子中C原子与S原子之间形成2对共用电子对,结构式为S=C=S;常温下,CS2为液态体,CO2为气态,故沸点CS2>CO2,
故答案为:S=C=S;CO2;
(3)m为Cu元素,晶胞中含铜原子个数=8×
+6×
=4,晶体中在每个铜周围与它最接近且距离相等的铜个数=3×8×
=12,
故答案为:4;12;
(4)N2原子个数为2,价电子总数为10,与氮气价电子总数相同的为:CN-、CO;故答案为:CN-、CO;
(5)A.Cu位于元素周期表中第四周期ⅠB族,属于ds区元素,故A错误;
B.Cr元素原子外围电子排布为3d54s1,位于第四周期、ⅥB族,属于ds区元素,故B错误;
C.g为镁元素,位于元素周期表中第三周期、ⅡA族,属于s区元素,故C正确;
D.j 为氯元素,位于元素周期表中第三周期、ⅦA族,属于p区元素,故D错误,
故答案为:C;
(6)将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到[Cu(NH3)4]2+络离子,溶液呈深蓝色,蓝色沉淀溶解在氨水中的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,Cu(NH3)4SO4?H2O是离子化合物,不溶于极性较小的乙醇中,降低Cu(NH3)4SO4?H2O的溶解度,故有晶体析出;
故答案为:先产生蓝色沉淀,后逐渐溶解,得到深蓝色溶液;析出深蓝色晶体;[Cu(NH3)4]2+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
 ;
;k为Cr元素,是25元素,Cr原子的电子排布式为1s22s22p63s23p63d54s1,外围电子排布为:3d54s1;
故答案为:
 ;3d54s1;
;3d54s1;(2)ci2与ce2分别为:CS2、CO2,CS2分子中C原子与S原子之间形成2对共用电子对,结构式为S=C=S;常温下,CS2为液态体,CO2为气态,故沸点CS2>CO2,
故答案为:S=C=S;CO2;
(3)m为Cu元素,晶胞中含铜原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:4;12;
(4)N2原子个数为2,价电子总数为10,与氮气价电子总数相同的为:CN-、CO;故答案为:CN-、CO;
(5)A.Cu位于元素周期表中第四周期ⅠB族,属于ds区元素,故A错误;
B.Cr元素原子外围电子排布为3d54s1,位于第四周期、ⅥB族,属于ds区元素,故B错误;
C.g为镁元素,位于元素周期表中第三周期、ⅡA族,属于s区元素,故C正确;
D.j 为氯元素,位于元素周期表中第三周期、ⅦA族,属于p区元素,故D错误,
故答案为:C;
(6)将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到[Cu(NH3)4]2+络离子,溶液呈深蓝色,蓝色沉淀溶解在氨水中的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,Cu(NH3)4SO4?H2O是离子化合物,不溶于极性较小的乙醇中,降低Cu(NH3)4SO4?H2O的溶解度,故有晶体析出;
故答案为:先产生蓝色沉淀,后逐渐溶解,得到深蓝色溶液;析出深蓝色晶体;[Cu(NH3)4]2+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
点评:考查元素周期表的结构、元素周期律、晶体结构、核外电子排布规律等,难度不大,注意掌握元素周期表的整体结构,了解1-36号元素在周期表中位置.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
下列有关铁及其化合物的说法中正确的是( )
| A、赤铁矿的主要成分是Fe3O4 |
| B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C、除去FeCl2溶液中的FeCl3杂质,向溶液中加入过量铁粉,过滤 |
| D、FeCl3与KSCN产生红色沉淀 |

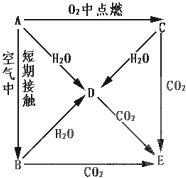 A、B、C、D、E五种物质都含有同一种活泼金属元素,它们按图所示关系相互转化,已知A为单质.
A、B、C、D、E五种物质都含有同一种活泼金属元素,它们按图所示关系相互转化,已知A为单质.
