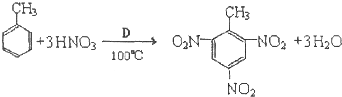
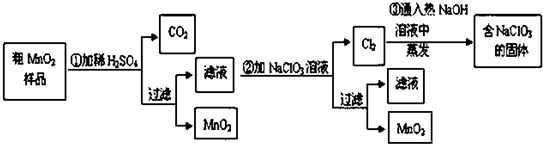
题目内容
我国南方某些地区的井水拿来久置后,井水由澄清透明变为有少量棕色絮状沉淀积于缸低,水面上浮着一层“锈皮”,当地居民常采用家明矾的方法处理.
(1)井水久置后水面一层“铁皮”的主要成分是 (写化学式);
(2)用化学方法鉴别该井水的步骤是 ;离子方程式为 ;
(3)用化学方法鉴别明矾处理后的水的步骤是 ,离子方程式为 .
(1)井水久置后水面一层“铁皮”的主要成分是
(2)用化学方法鉴别该井水的步骤是
(3)用化学方法鉴别明矾处理后的水的步骤是
考点:盐类水解的应用,二价Fe离子和三价Fe离子的检验
专题:
分析:(1)根据棕红色絮状沉淀分析;
(2)氧化铁可以和盐酸反应生成氯化铁溶液,Fe3+遇到KSCN,溶液变成红色,如果加入KSCN溶液变红说明含有三价铁离子,否则没有;
(3)根据明矾的成分分析、检验.
(2)氧化铁可以和盐酸反应生成氯化铁溶液,Fe3+遇到KSCN,溶液变成红色,如果加入KSCN溶液变红说明含有三价铁离子,否则没有;
(3)根据明矾的成分分析、检验.
解答:
解:(1)根据棕色絮状沉淀,可知该物质为Fe2O3,故答案为:Fe2O3;
(2)用化学方法鉴别该井水的方法:取水样,加入稀盐酸,Fe2O3+6H+=Fe3++H2O,再加入硫氰化钾,若变红色,说明含有三价铁离子,证明水中含有氧化铁,反之则没有,故答案为:取水样,加入稀盐酸,再加入硫氰化钾,若变红色,Fe3++3SCN-=Fe(SCN)3,说明含有三价铁离子,证明水中含有氧化铁,反之则没有;Fe2O3+6H+=Fe3++H2O,Fe3++3SCN-=Fe(SCN)3.
(3)明矾成分为硫酸铝钾,含有硫酸根离子,取少量加盐酸酸化,再加氯化钡溶液若生成白色沉淀,Ba2++SO42-=BaSO4↓,说明已经处理,否则没有;
故答案为:取少量加盐酸酸化,再加氯化钡溶液若生成白色沉淀说明已经处理,否则没有;Ba2++SO42-=BaSO4↓.
(2)用化学方法鉴别该井水的方法:取水样,加入稀盐酸,Fe2O3+6H+=Fe3++H2O,再加入硫氰化钾,若变红色,说明含有三价铁离子,证明水中含有氧化铁,反之则没有,故答案为:取水样,加入稀盐酸,再加入硫氰化钾,若变红色,Fe3++3SCN-=Fe(SCN)3,说明含有三价铁离子,证明水中含有氧化铁,反之则没有;Fe2O3+6H+=Fe3++H2O,Fe3++3SCN-=Fe(SCN)3.
(3)明矾成分为硫酸铝钾,含有硫酸根离子,取少量加盐酸酸化,再加氯化钡溶液若生成白色沉淀,Ba2++SO42-=BaSO4↓,说明已经处理,否则没有;
故答案为:取少量加盐酸酸化,再加氯化钡溶液若生成白色沉淀说明已经处理,否则没有;Ba2++SO42-=BaSO4↓.
点评:本题考查了离子的检验以及物质的性质,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
相关题目
体积和pH值均相等的A(一元强酸)和B(一元弱酸)两种酸溶液,已知B的电离度为1.3%,则两种酸中和碱的能力相比( )
| A、B是A的1.3倍 |
| B、B是A的76.9倍 |
| C、B是A的98.7倍 |
| D、无法判断 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
| A、H2O2+H2SO4=SO2↑+O2↑+2H2O |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、Cl2+SO2+2H2O=H2SO4+2HCl |
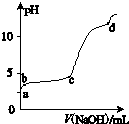 室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
室温下,在一定体积的0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )| A、d点时,c(Na+):c (SO42-)=8:3 |
| B、b~c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| C、a~b段,溶液无沉淀生成,Al3+浓度不变 |
| D、a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3 H2O?Al(OH)3+3 OH- |
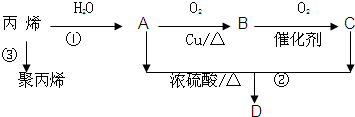
 A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题:
A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题: