题目内容
4.标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中正确的是( )| A. | c=$\frac{Vρ}{17V+22400}$ | B. | ω=$\frac{17c}{100ρ}$ | ||
| C. | ω=$\frac{17V}{17V+22400}$ | D. | ρ=$\frac{17V+22400}{22.4+22.4V}$ |
分析 A、表示出溶液的质量分数ω,然后带入c=$\frac{1000ρω}{M}$来计算;
B、根据c=$\frac{1000ρω}{M}$来计算;
C、根据质量分数=$\frac{{m}_{溶质}}{{m}_{溶液}}×100%$来计算;
D、根据n=$\frac{V}{Vm}$计算VL氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,进而计算溶液的质量,根据V=$\frac{n}{c}$计算溶液的体积,由ρ=$\frac{m}{V}$计算溶液的密度.
解答 解:A、标况下VL氨气的物质的量为$\frac{V}{22.4}$mol,质量为$\frac{17V}{22.4}$g,溶于1L水后所得溶液的质量分数ω=$\frac{\frac{17V}{22.4}g}{(\frac{17V}{22.4}+1000)g}×100%$=$\frac{17V}{17V+22400}×100%$,然后带入c=$\frac{1000ρω}{M}$=$\frac{1000ρ×\frac{17V}{17V+22400}×100%}{17}$=$\frac{1000Vρ}{17V+22400}$mol/L,故A错误;
B、根据c=$\frac{1000ρω}{M}$可知:ω=$\frac{cω}{1000ρ}=\frac{17c}{1000ρ}$,故B错误;
C、标况下VL氨气的物质的量为$\frac{V}{22.4}$mol,质量为$\frac{17V}{22.4}$g,溶于1L水后所得溶液的质量分数ω=$\frac{\frac{17V}{22.4}g}{(\frac{17V}{22.4}+1000)g}×100%$=$\frac{17V}{17V+22400}×100%$,故C正确;
D、VL氨气的物质的量为$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,氨气质量为$\frac{17V}{22.4}$g,1L水的质量为1000mL×1g/mL=1000g,故溶液质量为(=$\frac{17V}{22.4}$+1000)g,溶液体积为:$\frac{\frac{V}{22.4}mol}{cmol/L}$=$\frac{V}{22.4c}$L,所以溶液的密度为:$\frac{\frac{17V}{22.4}g+1000g}{\frac{V}{22.4c}×1000mL}$=$\frac{17cV+22400c}{1000V}$g/mL,故D错误;
故选C.
点评 本题考查质量分数、物质的量浓度的有关计算,难度中等,注意公式的理解与灵活运用,题目为字母型计算,计算量较大,需要学生细心观察进行计算.

| A. | 氯化氢分子的电子式: | B. | 乙烯的结构简式:CH2=CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: |
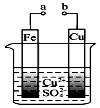
| A. | 构成原电池时Cu极反应为:Cu2++2e-=Cu | |
| B. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| C. | 要使Fe极不被腐蚀,Cu片换Zn片或将a与直流电源的负极相连 | |
| D. | a和b分别连接直流电源正、负极,Fe片上有气体产生 |
| A. | 4:13 | B. | 1:13 | C. | 1:3 | D. | 13:4 |
| A. | NH4Cl固体和NaCl固体-分别滴加NaOH溶液并加热 | |
| B. | K2SO4固体和Na2SO4固体-焰色反应 | |
| C. | HC1溶液和H2SO4溶液-分别滴加AgNO3溶液 | |
| D. | FeC13溶液和Fe(OH)3胶体一束强光照射 |
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是BD.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 胆矾、冰水混合物、四氧化三铁都不是混合物 | |
| C. | 分离胶体和某盐溶液,可用过滤的方法 | |
| D. | SO2、SiO2、CO均为酸性氧化物 |
| A. | 乙醇的分子式:C2H5OH | B. | C的基态原子核外电子轨道表示式: | ||
| C. | 氯化铵的电子式: | D. | CS2分子比例(填充)模型: |
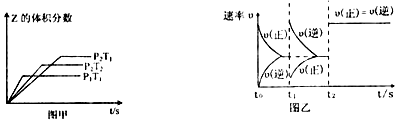
| A. | 图甲,P1>P2,a<3 | |
| B. | 图甲,T1<T2,Q>0 | |
| C. | 图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体 | |
| D. | 图乙,如果a=3,t2时表示向体系中加入了催化剂 |