题目内容
19.下列化学用语错误的是( )| A. | 氯化氢分子的电子式: | B. | 乙烯的结构简式:CH2=CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: |
分析 A.氯化氢是共价化合物,原子间形成共用电子对;
B.乙烯含有碳碳双键官能团,结构简式中写出;
C.分子式是把相同的原子个数标注在元素符号右下角写出分子式;
D.氯原子核外有17个电子,三个电子层最为层7个电子;
解答 解:A.氯化氢为共价化合物,分子中不存在阴阳离子,氯化氢正确的电子式为 ,故A错误;
,故A错误;
B.乙烯结构简式CH2=CH2,故B正确;
C.苯的分子式为:C6H6,故C正确;
D.氯原子核外有17个电子,三个电子层最为层7个电子,氯的原子结构示意图: ,故D正确;
,故D正确;
故选A.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握结构式、电子式、离子结构示意图、元素符号等化学用语的书写原则,明确结构式与结构简式、分子式、实验式的区别,试题培养了学生规范答题的能力.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
9.下列实验操作中,所用仪器合理的是( )
| A. | 在蒸发皿中放入NaCl溶液,加热、蒸发得到NaCl晶体 | |
| B. | 用10 mL量筒量取4.80 mL的盐酸 | |
| C. | 用托盘天平秤取25.20g NaCl | |
| D. | 用1000mL容量瓶配制450mL0.1 mol/L的盐酸 |
10.下列说法中正确的是(NA代表阿伏加德罗常数的值)( )
| A. | 7.1 g氯气和7.1 g氯水所含的分子数都是0.1 NA | |
| B. | 36.5 g氯化氢和36.5 g盐酸所含的分子数都是NA | |
| C. | 1 mol Mg转化为MgCl2必定有NA个Cl2分子参加了反应 | |
| D. | 1 mol Fe转化为Fe3+失去的电子数为3NA |
7.如图所示的装置中,金属片紧靠贴着滤纸,下列判断错误的是( )


| A. | 两处的锌片均发生氧化反应 | |
| B. | 左侧铜片上的电极反应为2H2O+O2+4e-═4OH- | |
| C. | 阳离子移动方向分别由②→①、③→④ | |
| D. | 最先观察到红色的区域是④ |
14.下列反应中都有水的参加,其中水既不做氧化剂,又不做还原剂的氧化还原反应是( )
| A. | Cl2+H2O═HCl+HClO | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | C+H2O═CO+H2 |
4.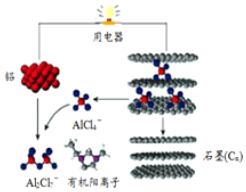 一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )
一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )
 一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )
一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )| A. | 该电池充电时的电子流向为:铝→用电器→石墨(C) | |
| B. | 该电池放电时石墨电极发生氧化反应 | |
| C. | 充电时的阴极反应为:4Al2Cl7-+3e-═Al+7AlCl4- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
11.0.1mol/L的HCl和0.1mol/L的CH3COOH溶液相比较,下列说法不正确的是( )
| A. | 含H+的物质的量,盐酸大于醋酸 | |
| B. | 分别于锌反应,产生H2的物质的量不一定相等 | |
| C. | 分别于镁反应,反应速率盐酸大于醋酸 | |
| D. | H+的物质的量浓度,盐酸大于醋酸 |
8.下列离子方程式正确的是( )
| A. | SO2与酸性KMnO4溶液的反应:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| B. | 稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
4.标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中正确的是( )
| A. | c=$\frac{Vρ}{17V+22400}$ | B. | ω=$\frac{17c}{100ρ}$ | ||
| C. | ω=$\frac{17V}{17V+22400}$ | D. | ρ=$\frac{17V+22400}{22.4+22.4V}$ |