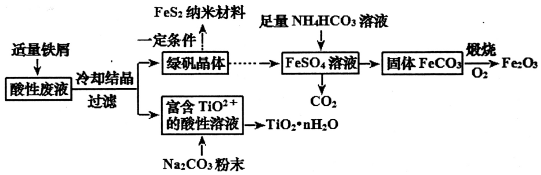
题目内容
19. 已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:
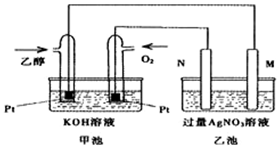
已知甲醇、乙醇都是重要的有机化工原料,回答下列问题:(1)图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是C.
A.M电极的材料是石墨
B.若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448mL
C.在此过程中,甲池中OH-向通乙醇的一极移动
D.在此过程中,乙池溶液中电子从M电极向N电极移动
(2)写出乙醇燃料电池正极的电极反应式O2+2H2O+4e-=4OH-.
(3)已知:甲醇脱水反应 ①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1
甲醇制烯烃反应 ②2CH3OH(g)=C2H4 (g)+2H2O(g)?△H2
乙醇异构化反应 ③CH3CH2OH(g)=CH3OCH3(g))?△H3
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H=△H1-△H2-△H3(用含△H1、△H2、△H3表示).
(4)工业上可利用CO或CO2来生产甲醇.甲醇制备的相关信息如表:
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
②反应②是吸热反应(选填“吸热”“放热”).
分析 (1)乙醇燃料电池中,通入乙醇的电极为负极,发生氧化反应;通入氧气的电极为正极,发生还原反应;M连接电源负极,则M为电解池的阴极,N连接电源的正极,则N为电解池的阳极;已知工作过程M、N两个电极的质量均不减少,则M为Fe、N为石墨,据此结合电子守恒进行解答;
(2)在燃料电池中,正极上是氧气发生得电子得还原反应;
(3)根据盖斯定律①-②-③可得C2H4(g)+H2O(g)═C2H5OH(g)的△H;
(4)①依据平衡常数概念和表达式计算分析得到关系;
②由表中数据可知反应平衡常数随温度升高而增大,根据平衡移动原理分析.
解答 解:(1)A.M为阴极,N为阳极,两极质量都不减少,说明铁做阴极,M电极材料为铁,故A错误;
B.乙池是电解池,阴极电极反应式为Ag++e-=Ag,质量增加4.32g为0.04mol,转移电子0.04mol,正极电极反应式为2H2O+O2+4e-=4OH-,转移0.04mol电子,需要氧气0.01mol,标准状况下体积为224mL,没有告诉在标准状况下,则氧气的体积不一定为224mL,故B错误;
C.在原电池中,阴离子移向负极,乙醇在负极反应,则甲池中氢氧根离子向乙醇的一极移动,故C正确;
D.溶液中离子定向移动形成电流,电子在电极和外电路中移动,不能在溶液中移动,故D错误;
故答案为:C;
(2)在碱性乙醇燃料电池中,正极上是氧气发生得电子得还原反应,电极反应为O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(3)甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)?△H2
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))?△H3
根据盖斯定律①-②-③可得:C2H4(g)+H2O(g)═C2H5OH(g)△H=△H1-△H2-△H3,
故答案为:△H1-△H2-△H3;
(4)①K1=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$,K2=$\frac{c({H}_{2}O)•c(CO)}{c({H}_{2})•c(C{O}_{2})}$,K3=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{{c}^{3}({H}_{2})•c(C{O}_{2})}$=K1•K2,
故答案为:K1•K2;
②分析图表数据,反应平衡常数随温度升高而增大,平衡正向进行,正反应是吸热反应,
故答案为:吸热.
点评 本题综合考查了原电池和电解池原理、盖斯定律、平衡常数的应用,试题培养了学生的分析能力及灵活应用能力,题目难度中等.

| A. | 在游泳池中常加CuSO4和漂白粉,它们使细菌蛋白质变性的原理相同 | |
| B. | 铜制品在潮湿空气中生锈,其主要原因是发生吸氧腐蚀 | |
| C. | “地沟油”禁止食用,但可以用来制肥皂,是利用了皂化反应 | |
| D. | 利用K2FeO4作水处理剂是因为它既有吸附性又有强氧化性 |
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 稀HNO3中加入过量的Fe 粉,充分反应后,滴入KSCN 溶液 | 溶液呈红色 | 稀HNO3将Fe 氧化为Fe3+ |
| B | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | Al 箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密了氧化膜 |
| A. | A | B. | B | C. | C | D. | D |
| A. | C4H6 | B. | C3H8 | C. | C2H4 | D. | CH4 |
| X | |||
| W | Y | Z |
| A. | X、Y和氢三种元素形成的化合物中可能既有离子键、又有共价键 | |
| B. | Y的氧化物的通入过量BaCl2溶液中一定会产生白色沉淀 | |
| C. | W元素的单质是良好的半导体材料,它与Z元素可形成化合物WZ4 | |
| D. | 物质W3X4中,每个原子最外层均达到8电子稳定结构 |
 ;
; ;
;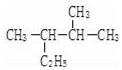 的名称(系统命名法)2,3-二甲基戊烷.
的名称(系统命名法)2,3-二甲基戊烷. 五种短周期元素X、Y、Z、W、Q的原子序数依次增.X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912.回答下列问题:
五种短周期元素X、Y、Z、W、Q的原子序数依次增.X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912.回答下列问题: