题目内容
15.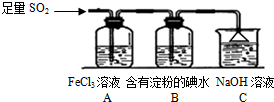 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,这样操作的目的是防止氯化铁水解.
(2)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
②请设计实验方案检验有Fe2+生成取A中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶
液变红;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了
SO42-.该做法不合理(填“合理”或“不合理”),理由是硝酸可以将SO32-氧化为SO42-,干扰试验.
(3)装置中能表明I-的还原性弱于SO2的现象是装置B中蓝色溶液褪色.
分析 (1)氯化铁为强酸弱碱盐,铁离子易水解而导致溶液浑浊;
(2)①二者发生氧化还原反应,生成硫酸根离子、亚铁离子;
②检验有Fe2+生成,利用KSCN和氯水,先不变红、后变红判断;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性;
(3)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,根据还原剂的还原性大于还原产物的还原性分析.
解答 解:(1)氯化铁为强酸弱碱盐,铁离子易水解而导致溶液浑浊,为防止氯化铁水解,所以在配制氯化铁溶液时先将氯化铁溶于浓盐酸中,然后稀释,故答案为:浓盐酸;抑制氯化铁水解;
(2)①二者发生氧化还原反应,生成硫酸根离子、亚铁离子,离子方程式为2Fe3++SO2+2H2O=SO42-+2Fe2++4H+,
故答案为:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
②铁离子和KSCN溶液反应而使溶液呈血红色,亚铁离子和KSCN不反应,氯气能氧化亚铁离子生成铁离子,所以检验亚铁离子的方法为取A中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红,
故答案为:取A中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶
液变红;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,故做法不合理,
故答案为:不合理;硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验;
(3)I2+SO2+2H2O=2HI+H2SO4二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,故答案为:装置B中溶液蓝色褪去.
点评 本题以二氧化硫为载体考查性质实验方案设计,为高频考点,明确实验原理及物质性质是解本题关键,注意:离子或物质检验时要排除其它因素的干扰,知道亚铁离子、铁离子的检验方法,题目难度不大.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案| A. | 蒸馏法 | B. | 电渗析法 | C. | 过滤法 | D. | 离子交换法 |
| A. | C2H4O4 | B. | CO | C. | C6H12O6 | D. | C12H22O11 |
| A. | 核电荷数为34 | B. | 中子数为16 | C. | 核外电子数为18 | D. | 原子序数为16 |
| A. | 将水加热到100℃,使pH=6 | B. | 向水中加入Al2(SO4)3固体 | ||
| C. | 向水中加入Na2CO3溶液 | D. | 向水中加入NaHSO4溶液 |
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| C. | 用氨水溶液氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H20 | |
| D. | Fe(OH)3 溶于过量的HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
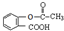 )是应用最广的解热镇痛药.通过乙二醇把阿斯匹林连接在高聚物E上,可制成缓释长效阿斯匹林.其合成过程如下:
)是应用最广的解热镇痛药.通过乙二醇把阿斯匹林连接在高聚物E上,可制成缓释长效阿斯匹林.其合成过程如下: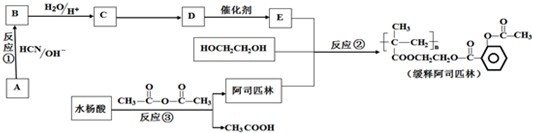
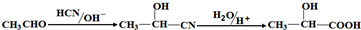
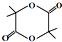 ;;聚合物
;;聚合物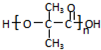 .
.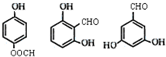 任意2种.
任意2种.