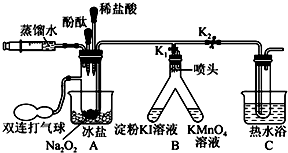
题目内容
5.除去FeCl3溶液中混有少量的FeCl2,试剂为氯气或氯水,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;除去FeCl2溶液中混有少量的FeCl3,试剂为铁粉,离子方程式为2Fe3++Fe=3Fe2+.分析 除杂不能引入新的杂质,则除去FeCl3溶液中的少量FeCl2,选择氯气或氯水等;除去FeCl2溶液中的少量FeCl3,选择铁粉.
解答 解:除杂不能引入新的杂质,除去FeCl3溶液中的少量FeCl2,选择氯气或氯水等,发生的离子反应为:2Fe2++Cl2=2Fe3++2Cl-;
除杂不能引入新的杂质,则除去FeCl2溶液中的少量FeCl3,选择铁粉,发生的离子反应为2Fe3++Fe=3Fe2+;
故答案为:氯气或氯水; 2Fe2++Cl2=2Fe3++2Cl-; 铁粉; 2 Fe3++Fe=3 Fe2+.
点评 本题考查除杂试剂的选择和离子方程式的书写,题目难度不大,注意相关物质的性质,注重基础知识的积累.

练习册系列答案
相关题目
20.80mL稀硫酸与足量氯化钡溶液反应,得到46.6g沉淀,此稀硫酸的浓度是( )
| A. | 5mol/L | B. | 1.25mol/L | C. | 2.5mol/L | D. | 3mol/L |
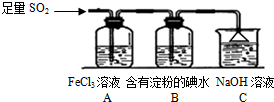 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: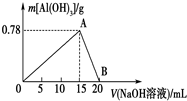 向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题: