题目内容
12.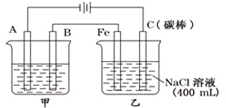 如图为相互串联的甲乙两电解池.
如图为相互串联的甲乙两电解池.(1)甲池若为用电解原理精炼铜的装置,①A是阴极,材料是精铜(或纯铜),电极反应为Cu2++2e-=Cu,②B是阳极,材料是粗铜,主要电极反应为Cu-2e-=Cu2+,电解质溶液为硫酸铜溶液.
(2)写出乙池中发生的总反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(3)若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为44.8L.
(4)若此时乙池剩余液体为400mL,则电解后得到碱液的物质的量浓度为1mol/L.
分析 (1)A与电源的负极相连,是电解池的阴极,所以是纯铜,发生还原反应;B是电解池的阳极铜发生氧化反应,电极反应式为Cu-2e-=Cu2+,电解液是含可溶性铜离子的电解质溶液;
(2)乙池是电解氯化钠溶液,发生的总反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)由Cu~Cl2↑;可计算阳极产生的气体体积;
(4)由2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑可知,生成氢氧化钠的物质的量,根据c=$\frac{n}{V}$进行计算.
解答 解:(1)①A与电源的负极相连,是电解池的阴极,所以是纯铜,发生还原反应,电极反应为:Cu2++2e-=Cu,故答案为:阴,精铜(或纯铜),Cu2++2e-=Cu;
②B是电解池的阳极铜发生氧化反应,电极反应式为Cu-2e-=Cu2+,电解液是含可溶性铜离子的电解质溶液,可以是硫酸铜溶液,故答案为:阳,粗铜,Cu-2e-=Cu2+,硫酸铜溶液;
(2)乙池是电解氯化钠溶液,发生的总反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)由2Cu~~~~Cl2↑;
64g 22.4L
12.8g 44.8L
故答案为:44.8L;
(4)由2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑可知,生成氢氧化钠的物质的量为0.4mol,所以c=$\frac{n}{V}$=$\frac{0.4mol}{0.4L}$=1mol/L,故答案为:1.
点评 本题考查原电池和电解池原理、热化学反应,明确各个电极上发生的反应是解本题关键,会正确书写电极反应式,此知识点为高考高频点,熟练掌握.

| A. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | B. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(OH-)>c(H+)>c(Na+)>c(CH3COO-) | D. | c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
| A. | 3.5 mol/L | B. | 4.5 mol/L | C. | 7.0 mol/L | D. | 9.0 mol/L |
①使澄清石灰水变浑浊
②使湿润的蓝色石蕊试纸变红
③使品红溶液褪色
④通入足量NaOH溶液中,再滴加BaC12溶液,有白色沉淀生成,该沉淀溶于稀盐酸.
| A. | 只有④能证明 | B. | 都不能证明 | C. | ③④均能证明 | D. | 都能证明 |
| A. | 苯是无色、带有特殊气味的液体 | |
| B. | 苯分子中键与键的夹角是120° | |
| C. | 苯在一定条件下能与溴发生取代反应 | |
| D. | 苯中不含碳碳双键,所以不可能发生加成反应 |
| A. | 该溶液中,Na+、H+、Cl-、Mg2+可以大量共存 | |
| B. | 与KSCN溶液反应产生红色沉淀 | |
| C. | 加入铜粉,反应的离子方程式为:Cu+Fe3+=Cu2++Fe2+ | |
| D. | 向该溶液中滴入少量Na2S溶液,反应的离子方程式为:2Fe3++3S2-+6H2O=3H2S↑+2Fe(OH)3↓ |
| A. | 在牙膏中添加Na2PO3F、NaF或SrF2等均能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的 | |
| B. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤的方法除去 | |
| C. | 家用“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 | |
| D. | 可用蘸取浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
| A. | XH8-3n | B. | HX | C. | XH2n | D. | HnX |
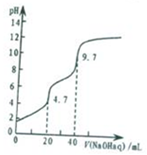 常温下,用0.1000mol•L-1 NaOH溶液滴定20mL0.1000mol•L-1 H3PO4溶液,滴定曲线如图所示,下列说法错误的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20mL0.1000mol•L-1 H3PO4溶液,滴定曲线如图所示,下列说法错误的是( )| A. | NaH2PO4溶液呈酸性 | |
| B. | pH=9.7处,c(Na+)>c(HPO42-)>c(OH-)>c(H+) | |
| C. | pH=4.7处,c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-) | |
| D. | 当2<pH<4.7时,H3PO4的第一步电离平衡常数均相等 |